TTZ Lampoldshausen
Seminar
24. Mai 2012
74329 Hardthausen-Lampoldshausen
Zoltán Faragó
Verbrennungsvorgänge in Kaminöfen
Wirtschaftsförderung Raum Heilbronn GmbH,
Technologie-Transfer-Zentrum Lampoldshausen,
Deutsches Zentrum für Luft- und Raumfahrt e.V.

Gliederung:
Grundlagen
Chemie der Holzverbrennung
Flammenleuchten – Rußbildung
Lesen aus der Flamme
Formel und Kennzahlen
Optimales Feuern
Chemische
Reaktionen bei der Holzverbrennung
Da mehr als 90 Prozent Energieanteil bei der Holzverbrennung in der Gasphase stattfindet, müssen zum Verständnis der Verbrennungsvorgänge einige Grundbegriffe der homogenen Gasverbrennung erörtert werden.
Homogene und heterogene Reaktion
Eine chemische Reaktion ist homogen, wenn alle beteiligten Partner den gleichen Aggregatszustand aufweisen, z.B. gasförmig. Beispiel:
2 H2 + O2 = 2 H2O (1)
Die Reaktion ist heterogen, wenn die Reaktanten in verschiedenen Phasen vorliegen.
Bei Feststoffverbrennung laufen homogene und heterogene Reaktionen gleichzeitig ab. Tabelle 1 zeigt Gewichts- und Energieanteile der homogenen und der heterogenen Verbrennung einiger fester Brennstoffe.
|
|
|
Kohlenstoff (wasser- u. aschefrei) % |
Brennbare Gase % |
Heterogener Anteil Gew. % |
Energieanteil der homogenen Gasverbrennung % |
Energieanteil der heterogenen Verbrennung % |
|
|
||||||
|
Holz |
45 – 50 |
40 – 45 |
5 – 10 |
> 95 |
3 – 5 |
|
|
Braunkohle |
65 – 75 |
43 – 60 |
|
|
|
|
|
Flammkohle |
75 – 82 |
40 – 45 |
30 – 40 |
> 80 |
10 – 20 |
|
|
Gasflammkohle |
82 – 85 |
35 – 40 |
40 – 50 |
> 75 |
15 – 25 |
|
|
Gaskohle |
85 – 87 |
28 – 35 |
50 – 60 |
> 70 |
15 – 30 |
|
|
Fettkohle |
87 – 89 |
19 – 28 |
60 – 70 |
> 65 |
20 – 35 |
|
|
Esskohle |
89 – 90 |
14 – 19 |
65 – 75 |
> 60 |
25 – 40 |
|
|
Magerkohle |
90 – 91,5 |
12 - 14 |
> 75 |
> 55 |
25 – 45 |
|
|
Anthrazit |
> 91,5 |
< 12 |
> 80 |
> 50 |
25 – 50 |
|
Globalreaktion
Die Kohlenstoffverbrennung in der Glutphase wird durch verschiedene heterogene Schritte eingeleitet (2a) und (2b) und durch homogene Reaktionsschritte beendet (2c) und (2d). Die Summe der Reaktionen ist die Summenreaktion oder globale Reaktion (2e). Die Reaktionen (2a) bis (2e) sind Teile der Wassergas-, Synthesegas- und Shiftgasreaktion und sind miteinander verknüpft. Die Kenntnis dieser Reaktionen hilft auch, bei Stückholzverbrennung die Kohlenmonoxidbildung zu reduzieren.
C + CO2 = 2 CO (2a)
C + H2O = CO + H2 (2b)
3 CO + 3 H2O = 3 CO2 + 3 H2 (2c)
4 H2 + 2 O2 = 4 H2O (2d)
-------------------------------
Summenreaktion: 2 C + 2 O2 = 2 CO2 oder
C + O2 = CO2 (2e)
Die globale Reaktionsgleichung gibt an, welche Gewichts- oder Volumenanteile von Brennstoff und Oxidator an der Verbrennungsreaktion teilnehmen und welche Wärmemenge dabei entsteht. Mit Hilfe der globalen Reaktionsgleichung können beispielshalber Schornstein, Luftkanal und Feuerstätte dimensioniert werden. Die globale Verbrennungsreaktion beschreibt aber nicht die Art und Weise, wie und durch welche Reaktionsschritte die Verbrennung abläuft.
Methanverbrennung
in Sauerstoff beziehungsweise in Luft:
CH4 + 2 O2 =
CO2 + 2 H2O (3)
1Vol. CH4
+2Vol. O2 = 1Vol. CO2 + 2Vol. H2O (3a)
1 Vol.
CH4 + 2 Vol. O2 + 8Vol. N2 = 1 Vol. CO2 + 2 Vol. H2O + 8 Vol. N2
(3b)
1 Vol. CH4
+ 10 Vol. Luft =
1 Vol. CO2 + 8 Vol.
N2 + 2 Vol. H2O (3c)
Gleichung (3a) besagt, dass für die stöchiometrische Verbrennung von 1 m³ Methan 2 m² Sauerstoff benötigt werden und dabei 1m³ Kohlendioxid und 2m² Wasserdampf entstehen. Wenn Sauerstoff in 1:4-Verhältnis mit Stickstoff verdünnt wird, wird die Reaktion durch Gl. (3b) beschrieben. Da die Luftzusammensetzung dem O2:N2-Verhältnis von etwa 1:4 entspricht, werden für die Verbrennung von 1 m³ Methan genau 10 m³ Luft benötigt, s. Gl. (3c); dabei entstehen 9 m³ trockenes (1 m³ CO2 und 8 m³ N2) beziehungsweise 11 m³ feuchtes Abgas.
Die globale Verbrennungsreaktion nach Gl. (3) findet in der Wirklichkeit nicht in einem Reaktionsschritt statt. Erstens, weil Methan und Sauerstoff stabile Moleküle sind, und stabile Molekülen reagieren nicht miteinander. Zweitens, weil Methanmoleküle und zwei Sauerstoffmoleküle [linke Seite von Gl. (3)] drei Moleküle sind, und zur Reaktion in einem Schritt daher drei Moleküle gleichzeitig zusammenstoßen müssten. Die Wahrscheinlichkeit eines „Dreierstoßes“ ist aber unendlich klein. Um die Reaktion nach Gl. (3) in Gang zu setzen, bedarf es einer Zündung. Bei der Zündung „zerbrechen“ einige stabile Moleküle und bilden hoch-reaktionsfähige Radikale. Für die Verbrennung von Methan ist der erste Reaktionsschritt, die Zündreaktion, meistens:
CH4 ↔ CH3‘ + H‘ (4)
Die Dissoziation von Methan in CH3‘- und H‘-Radikale nimmt oberhalb von 600 °C an Bedeutung zu. 600 °C ist gleichzeitig die Zündtemperatur der Methan-Luft-Mischung. Der komplette Mechanismus der Verbrennung wird durch die Elementarschritte (Teilreaktionen) beschrieben.
Elementarschritte und Teilreaktionen
Die Bilder 4 und 5 zeigen Elementarschritte der Methanverbrennung mit Luft im Luftmangel- und Luftüberschussbereich.

Bild 4: Beispiel für Elementarschritte der Methanverbrennung nach Warnatz
(Quelle: Bundesgesellschaft Phys. Chem. 87, 1008 (1983)
Ein detaillierter Teilmechanismus der Methanverbrennung in der Luft ist in den Bildern 4 und 5 dargestellt. In diesen Bildern ist die von oben nach unten gerichtete vertikale Spalte die Oxidation, die von links nach rechts gerichtete horizontale Spalte die Polymerisation. Bild 5 zeigt einen Teilbereich von Bild 4. Die Dicke der Pfeile in Bild 5 zeigt die Wahrscheinlichkeit des jeweiligen Reaktionsschrittes.
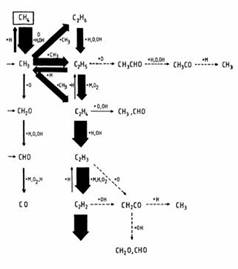
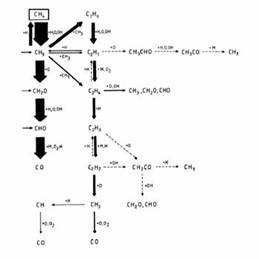
Luftmangel Luftüberschuss
Bild 5:Teilbereiche aus Bild 4; links Luftmangel/Flammenmitte; rechts Luftüberschuss/Flammenrand
Aus den Bildern 4 und 5 ist ersichtlich, dass mehrere Wege bei der Methanverbrennung zu CO2-Bildung führen können: Im Luftüberschussbereich verläuft die Oxidation geradlinig, in den Bildern sind diese Schritte von oben nach unten angeordnet dargestellt. Im Luftmangelbereich sind die Oxidationsschritte immer wieder durch Polymerisationsschritte unterbrochen; diese sind in den Bildern von links nach rechts angeordnet.
Ablauf der Holzverbrennung

Bild 6: Ablauf der Verbrennungsvorgänge bei Stückholzfeuerung (Quelle für Holzgaszusammensetzung: United Nations FOA72 document)
Bei der Verbrennung erwärmt sich zunächst das Stückholz. Bei 120 °C endet die Trocknungsphase, es beginnt die Entgasung. Das aus dem Holz entweichende Gas enthält in der Entgasungsphase N2, CO2, CO, CH4 und in geringer Konzentration CnHm. Während der Vergasungsphase wächst der Gasanteil an N2 und CO, die Konzentration an CO2 und H2 fällt geringfügig, die Konzentration an CH4 und CnHm fällt stark. Das Holzgas leuchtet schwach bläulich, da während der Entgasung Pyrolysereaktionen stattfinden und die sich bildenden CH‘-Radikale [s. Gl. (4)] blaues Licht emittieren.
Das Holzgas mischt sich mit der Luft durch Diffusion. Die Bezeichnung „Diffusionsflamme“ drückt aus, dass Verbrennung und Mischung (Diffusion) im gleichen Raum zur gleichen Zeit stattfinden. Die Holzgaszone grenzt an den fetten (luftarmen) Flammenbereich, der wiederum an den mageren (brennstoffarmen) Flammenbereich angrenzt, wie dargestellt in Bild 6. Das Brenngas diffundiert in Richtung Luft und umgekehrt.
Das intensiv-gelbe Leuchten der Diffusionsflamme wird von der hohen Rußkonzentration in der fetten Flammenmitte verursacht. Am mageren Flammenrand verbrennt der Ruß, der Flammenrand wird transparent. Flammenfarbe und Flammentransparenz werden von Rußkonzentration und Flammentemperatur bestimmt.
Diffusionsflamme und Vormischflamme

Bild 7: Prinzipskizze des Diffusionsbrenners (links und Mitte) und des Vormischbrenners (rechts)
Beim Diffusionsbrenner finden Vermischung und Verbrennung gleichzeitig statt (Bild 7, links). Die Bereiche „Brennstoffüberschuss“, „Stöchiometrisch“ und „Luftüberschuss“ (Bildmitte) sind Mischungsbereiche und Flamme zugleich. Die Verbrennungsreaktionen der Methanverbrennung finden im Brennstoffüberschussbereich gemäß Bild 5a statt, während im Brennstoffmangelbereich die Reaktion gemäß Bild 5b verläuft. Demnach zeigt Bild 5a eine hohe Konzentration an C2H2-Radikalen (Ethylen, siehe roter Pfeil in Bild 5a). Ethylen ist ein Rußbaustein: Rußbildung findet im Luftmantelbereich statt. Demgegenüber entsteht im Luftüberschussbereich eine hohe Konzentration an CH2O-Radikalen (Formaldehyd, blauer Pfeil in Bild 5b). Beide Schadstoffbildungen (Ruß und Formaldehyd) können durch Intensivierung der Durchmischung, also durch das Vermeiden extremer Konzentrationsschwankungen in der Flamme, reduziert werden.
Im Bild 7 rechts wird die Prinzipskizze des Vormischbrenners gezeigt. Hier wird die Brennstoff-Luft-Vermischung abgeschlossen, bevor die Verbrennung beginnt. Die Verbrennung ist schadstoffarm und rußfrei. Beim Fehlen des vom Ruß abgestrahlten gelben Lichtes der Diffusionsflamme wird im Vormischbrenner die „Originalfarbe“ der Verbrennung (blau) sichtbar (siehe Kapitel: Aus der Flamme lesen).
Stückholz verbrennt im Kaminofen stets als laminare oder turbulente Diffusionsflamme.


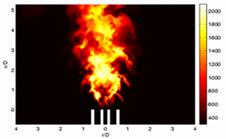

Bild 8: Laminare und turbulente Diffusions- und Vormischflammen - von links nach rechts:
laminare Diffusionsflamme; laminare Vormischflamme; turbulente Diffusionsflamme (F. Flemming, TU Darmstadt);
turbulente Vormischflamme (J. Wolfrum, Uni Heidelberg)
Dissoziation und Wärmetönung
Die Verbrennung von Kohlenmonoxid, Gleichungen (2a – 2e), kann man auch in der Schreibweise nach Gleichung (5) darstellen. Durch das Einführen der Gleichgewichtskonstante K wird hervorgehoben, dass es sich um eine Gleichgewichtsreaktion handelt. ∆H ist die Reaktionsenthalpie und zeigt die Wärmetönung der Reaktion an. Der Terminus für Enthalpie ist in der Feuerungstechnik der Brennwert oder „obere Heizwert“ Ho.
![]() (5)
(5)
Ist bei der Reaktion (5) die CO- und/oder O2-Konzentration hoch und die CO2-Konzentration niedrig, so verläuft die Reaktion von links nach rechts. Dadurch sinkt die CO- und O2-Konzentration und steigt die CO2-Konzentration, bis sich ein Gleichgewicht einstellt und sich die Konzentrationen nicht mehr ändern. Aus diesen Konzentrationen kann die Gleichgewichtskonstante K bestimmt werden:
![]() (6)
(6)
K Dissoziationskonstante (Gleichgewichtskonstante)
P Partialdruck der entsprechenden Gaskomponente.
![]() (7)
(7)
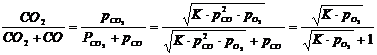 (8)
(8)
Gl. (6) folgt aus Gl. (5) nach Entlogarithmierung: aus Addition wird Multiplikation, aus Multiplikation wird Potenzierung. Erster Schritt in Gl. (8) folgt aus der Gastheorie: der Partialdruck der Gase entspricht ihrem Volumenanteil. Der zweite Schritt ist das Einsetzen von Gl. (7) in Gl. (8). Der letzte Schritt ist die Multiplikation im Zähler und Nenner mit 1/pCO.
Die Dissoziationskonstante K ist stark temperatur- und druckabhängig. Für die Änderung von K mit Druck und Temperatur gilt das Gesetz von Le Chatelier: Wird das Gleichgewicht gestört, so ändert sich K in die Richtung, welche die Folge der Änderung minimiert. Wirkt auf ein Stoffgemisch, das sich im chemischen Gleichgewicht befindet, ein äußerer Zwang, so weicht es diesem aus ("Prinzip vom kleinsten Zwang"). Es wird immer die Reaktion begünstigt, mit der dem äußeren Zwang am besten entgegengewirkt werden kann. Dieses Prinzip wurde von Le Chatelier 1884 formuliert und nach ihm benannt. Erhöht man z.B. den Druck bei der Reaktion nach Gl. (6), so verschiebt sich die Reaktionsrichtung nach rechts, da dies zur Druckminderung führt, die Druckerhöhung wird nach dem Prinzip von Le Chatelier verkleinert.
Erhöht man die Temperatur bei einer exothermen Verbrennungsreaktion, so ändert sich nach dem Prinzip von Le Chatelier K so, dass statt der Verbrennungsrichtung die Dissoziationsrichtung gefördert wird. Je höher die Reaktionstemperatur, umso höher ist bei exothermen Reaktionen die Dissoziation. Bei endothermen Verbrennungen hingegen (z.B. Stickoxidbildung) führt die Erhöhung der Verbrennungstemperatur zur Verschiebung in die Verbrennungsrichtung.
Ist die Reaktion exotherm, so wird DH mit negativem Vorzeichen in die Bruttoreaktionen eingeführt wie gezeigt in Gleichung (5). Verläuft hingegen die Reaktion endotherm, wird DH mit positivem Vorzeichen versehen.

Bild 9: Dissoziation von H2O, CO2 und SO3 im Feuerraum bei 10 % Luftüberschuss
Bild 9 zeigt den Dissoziationszustand von H2O, CO2 und SO3 im Feuerraum bei 10 % Luftüberschuss.
Anhand der CO2-CO-O2-Dissoziation nach Gleichungen (5) – (8) lässt sich folgendes feststellen:
Ist die Feuerraumtemperatur zu niedrig (etwa unter 1300 K, ≈ unter 1000°C), so ist der
Gleichgewichtszustand verschoben in Richtung CO2-Bildung (also wenig CO). Trotzdem führt
ein zu kalter Feuerraum zum Anstieg der CO-Bildung, da die Reaktionsgeschwindigkeit zu
niedrig ist.
Ist die Feuerraumtemperatur zu hoch (etwa über 1500 K), so dissoziiert CO2 teilweise zu CO +
O2. In diesem Fall sollte die Abgastemperatur im Bereich 1200 < T < 1500 K lang-
sam abgekühlt werden, damit die Reaktion nicht bei zu hoher Temperatur (zu hoher CO-
Konzentration) einfriert.
Durch Erhöhung der Luftzahl kann der Gleichgewichtszustand in Richtung CO2-Bildung / CO-
Reduktion verschoben werden. Doch führt diese Maßnahme oft zur Erhöhung der CO-
Konzentration im Abgas, da zu hohe Luftzahl zur Senkung der Feuerraumtemperatur führt
und daher der Gleichgewichtszustand der CO2-CO-O2-Dissoziation nicht erreicht wird.
So kann sowohl eine Erhöhung als auch eine Reduzierung der Luftzahl zu Erhöhung der CO-
Bildung führen. Dies ist die Erklärung der „Badewannenkurve“ im CO-Luftzahl-Diagramm.
|
Luftzahl l |
CO [ppm] bei 1650 K |
CO [ppm] bei 1600 K |
CO [ppm] bei 1550 K |
CO [ppm] bei 1500 K |
|
1,02 |
70 |
40 |
20 |
10 |
|
1,05 |
55 |
30 |
15 |
8 |
|
1,10 |
35 |
20 |
10 |
5 |
|
1,20 |
16 |
10 |
6 |
3 |
|
1,40 |
12 |
7 |
4 |
2 |
|
1,80 |
5 |
3 |
2 |
1 |
Tabelle 2: Gerechnete CO-Gleichgewichtskonzentration im
Feuerraum bei Verbrennung von C10H22
(Rechnung mit: Sanford Gordon and
Bonnie J. McBride: „Computer Program for Calculation of Complex Chemical
Equilibrium Compositions“, 1994)
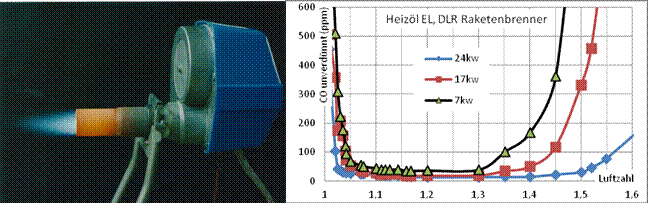
Bild 10: CO-Konzentration im Abgas als Funktion der Luftzahl bei Ölverbrennung (Messung mit BINOS-Gasanalysator)
Bild 10 zeigt den wannenförmigen Verlauf der Kohlenmonoxidbildung (Badewannenkurve) für den DLR-Blaubrenner für verschiedene Brennerleistungen
als Funktion der Luftzahl. Aus dem Diagramm ist ersichtlich, dass die Robustheit des Brenners mit der Reduzierung der Brennerleistung abnimmt.
![]()
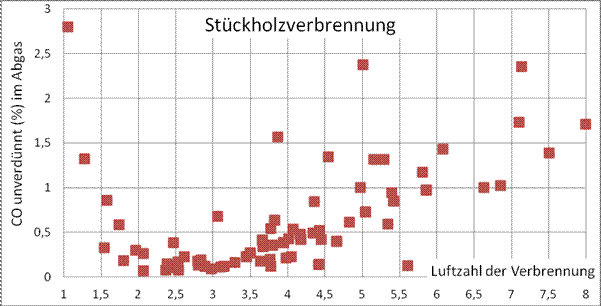
Bild 11: CO-Konzentration im Abgas als Funktion der Luftzahl bei Stückholzverbrennung (Messung mit rbr-ecom-J2KN).
In Bild 11 ist der wannenförmige Verlauf der Kohlenmonoxidbildung in einem Stückholzkamin (Nennleistung 8 kW) erkennbar.
Zum Vergleich der Ölfeuerung mit der Stückholzfeuerung (24 kW) sind die Messwerte aus Diagramm 10 in
![]() Bild
11 eingetragen ( ).
Bild
11 eingetragen ( ).
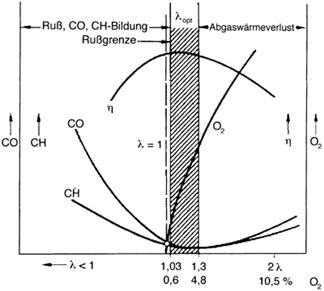
Bild 12: Schadstoffbildung in einem Gasheizkessel (Quelle: http://www.ikz.de/1996-2005/2001/20/0120028.php )
Die Badewannenkurven der Schadstoffbildung als Funktion der Luftzahl sind allgemeingültig, sie gelten für alle Schadstoffe bei allen Feuerungsarten und für alle Brennstoffe, wie angedeutet in Bild 12.
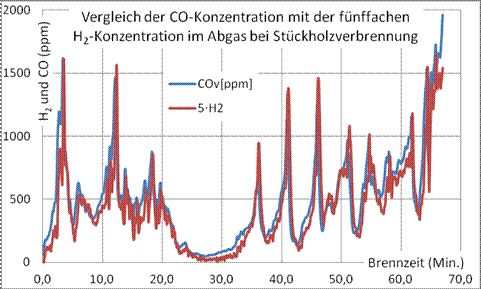
Bild 13: Gleichgewicht zwischen CO- und H2-Konzentration im Abgas bei Stückholzverbrennung (Messung mit Wöhler-A-600)
Die Verbrennung ist unvollständig, wenn die Abgase brennbare Bestandteile beinhalten. Die Tatsache, dass alle brennbaren (reduzierenden) und oxidierenden Gaskomponenten
CO, H2, CnHm, CO2, H2O, O2, OH’, NO usw.
ein Gleichgewicht miteinander anstreben, bedeutet, dass beim Nachweis eines einzigen Schadstoffes mit dem Vorhandensein aller Schadstoffe gerechnet werden muss. Als Beispiel zeigt Bild 13 den Zusammenhang zwischen CO- und H2-Konzentration im Abgas bei Stückholzfeuerung.