Brennstoffkunde
Entstehung fossiler Brennstoffe
Kohle
Erdöl
Erdgas und Flüssiggas
Brennstoffvorräte
Nachwachsende Brennstoffe
Brennstoffchemie
Tabelle 1 Zusammensetzung fester Brennstoffe (Holz, Braunkohle, Steinkohle)
Seite 4
Tabelle 12 Zusammensetzung der wichtigsten Brenngase
Seite 23
Tabelle 13 Elementaranalyse der wichtigsten flüssigen und gasförmigen Brennstoffe
Seite 23
Tabelle 14 Kennzahlen der wichtigsten flüssigen und gasförmigen Brennstoffe
Seite 23
Entstehung fossiler Brennstoffe
Steinkohle, Braunkohle, Ölsande, Ölschiefer, Lignit, Gashydrate, Erdgas, Erdöl, Torf etc. sind
fossile Brennstoffe. Sie sind aus der Biomasse früherer Zeiten entstanden. Die wichtigste chemische Reaktion bei der Entstehung von Biomasse ist die Photosynthese, eine chemische Reaktion, bei der aus Kohlendioxid und Wasserdampf mit Hilfe von Photonen (Lichtenergie) Zucker und Sauerstoff entstehen:
6 CO2 + 6 H2O + Lichtenergie Þ C6H12O6 + 6 O2 (1)
Aus den Zuckermolekülen entstehen durch Polymerisation Stärke und Cellulose, die wiederum in andere biologische Stoffe umgewandelt werden können. Die heute von uns genutzten fossilen Energieträger haben sich durch geologisch bedingte Umwandlungen aus organischen Stoffen gebildet: Vor rund zwei Milliarden Jahren haben sich Lebewesen entwickelt, die mit Hilfe des Farbstoffes „Chlorophyll“ die Reaktion nach Gl. (1) ermöglichen. Damals war die Erdatmosphäre sehr arm an Sauerstoff. Den Luftsauerstoff der Atmosphäre hat die Photosynthese aus Kohlendioxid und Wasser erzeugt, gleichzeitig wurde Biomasse produziert. In Kenntnis der Sauerstoffmasse der Atmosphäre kann aus Gl. (1) die gesamte Biomasse der Erde errechnet werden.
Würde man zur Deckung des weltweiten Energiebedarfes die als fossiler Brennstoff konservierte Biomasse verbrennen, wäre der Luftsauerstoff nach Gl. (2) restlos in Kohledioxid zurückgewandelt, da die Verbrennung eine Umkehrung der Photosynthese darstellt:
C6H12O6 + 6 O2 Þ 6 CO2 + 6 H2O + Verbrennungswärme (2)
Die Verbrennung fossiler Brennstoffe träg dazu bei, die heutige Erdatmosphäre der vor Milliarden Jahren ähnlich zu machen (Klimakatastrophe!), da zwischen Entstehung und Verbrennung dieser Brennstoffe Jahrmilliarden liegen. Die Verbrennung nachwachsender Brennstoffe ist wiederum CO2-neutral, da zwischen der Entstehung und der Verbrennung in diesem Fall nur eine kurze Zeitspanne vorhanden ist.
Fossile Brennstoffe sind tote Biomasse, welche vor Jahrmillionen abgestorben ist und durch geologische Prozesse in Steinkohle, Braunkohle, Lignit, Torf, Erdöl und Erdgas sowie verschiedene Mischprodukte wie Ölsande, Ölschiefer, Gashydrate etc umgewandelt wurde. In einer ersten Stufe werden Pflanzen und Tiere kurz nach ihrem Absterben durch Schlamm oder Wasser vom Luftsauerstoff abgetrennt - beispielsweise Vegetationsflächen, die überflutet werden, oder Tiere, die im Schlamm einsinken. Die darauf folgende anaerobe, also sauerstofflose Zersetzung durch entsprechende Mikroorganismen überführt die tote Biomasse in Kohlenstoff- und Kohlenwasserstoffverbindungen verschiedener Zusammensetzung sowie andere Verbindungen mit einer Konzentrierung des Kohlenstoffgehalts.
Aufgabe 1: Berechnen Sie anhand Gl. (1) den Kohlenstoffgehalt der gesamten Biomasse der Erde unter der Annahme, dass sowohl die organische Kohlenstoffmasse als auch die Sauerstoffmasse in der Atmosphäre durch die Photosynthese entstanden ist. Die Sauerstoffmasse der Atmosphäre beträgt ca. 1,2 ×109 Millionen Tonne. Vergleichen sie die errechnete Kohlenstoffmasse mit der Masse der Biosphäre in Abbildung 4 der Vorlesung „Feuerungen und Umwelt“.
Aufgabe 2: Zeigen Sie anhand der Reaktionen nach den
Gleichungen (1) und (2), dass die Verbrennung fossiler Brennstoffe die
Umwandlung von der Sonnenenergie in Wärme bedeutet.
Kohle
Umrechnungen: Die durchschnittliche chemische Energie (Verbrennungswärme) der Steinkohle ist die Steinkohleneinheit, SKE. Eine Tonne Steinkohleneinheit (1 t SKE) entspricht der Verbrennungswärme von etwa 0,691t Erdöl, oder 850 Nm3 Erdgas und ist 29×109 Joule. Nach den bekannten „sicheren Reserven“ ist der weltweite Kohlebedarf etwa für 200 Jahre gedeckt.
Kohlenbildung oder Inkohlung bezeichnet den unter fast vollständigem Sauerstoffabschluss erfolgenden Umbildungsvorgang von pflanzlicher Substanz zu den verschiedenen Kohlenarten. Stein- und Braunkohle haben sich vor 350 – 270 Millionen Jahren im feuchtheißen Klima des Karbonzeitalters aus Sumpfmoorwäldern gebildet. Typische Pflanzen dieser Wälder waren große Farne, baumartige Schachtelhalme und Schuppenbäume. Zunächst entstand torfähnliches Material und dann durch Inkohlungsprozesse unter Druck Braunkohle. Erst durch größeren tektonischen Druck und höhere Temperatur bildete sich Steinkohle. Durch längerfristige Einwirkung von Auflastdruck und erhöhter Temperatur nimmt der relative Anteil an Kohlenstoff zu und der Anteil an flüchtigen Stoffen ab (CH4 , CO2).
Nach Art der organischen Ausgangsstoffe unterscheidet man Humus- und Sapropel-Kohlen, zwischen denen aber Übergänge bestehen. Humus-Kohlen sind aus dem Lignin und der Cellulose von Pflanzen hervorgegangen, Sapropel-Kohlen (Bitumen-Kohlen) aus den Eiweiß- und Fettstoffen des Faulschlamms. Die Humus-Kohlen machen über 80% aller Kohlen aus. Nach dem Inkohlungsgrad und anderen damit in Zusammenhang stehenden Merkmalen teilt man die Kohlen in zwei Gruppen ein, Braunkohle und Steinkohle, diese wiederum in verschieden Arten (Tab. 1).
Bei der Weich-Braunkohle (von Baumstümpfen und Baumstämmen durchsetzt) unterscheidet man erdige (weiche) und stückige Sorten, bei der Hart-Braunkohle die schwarzbraune, dichte Matt-Braunkohle und die schwarze, harte, durch muscheligen und glänzenden Querbruch charakterisierte Glanz-Braunkohle (auch Pech-Kohle genannt). Die einzelnen Arten der Steinkohle (mit zunehmenden Inkohlungsgrad) sind: Flamm-Kohle, Gasflamm-Kohle, Gas-Kohle, Fett-Kohle, Ess-Kohle, Mager-Kohle und Anthrazit. Bei Braunkohle bestehen die organischen Bestandteile aus dem Bitumenanteil (vor allem Harze und Wachse) sowie aus Huminstoffen (humusbildende Stoffe). Daneben enthält jede Kohle anorganische, unverbrennbare Ballaststoffe (Aschebestandteile). Das in den Kohle-Flözen enthaltene Grubengas (hauptsächlich Methan) ist bei der Inkohlung frei geworden, die Kohlensäure größtenteils zugewandert (vulkanischen Ursprungs).
Die chemische Zusammensetzung der Kohle ist äußerst kompliziert. Bei der Steinkohle liegen nur 10% des Kohlenstoffs frei vor; der Rest ist in einem Verbindungsgemisch enthalten, das vor allem aus aliphatischen und aromatischen Kohlenwasserstoffen besteht, in denen außer Sauerstoff zum Teil auch Schwefel und Stickstoff chemisch gebunden sind. Humuskohlen bestehen zu einem großen Teil aus aliphatischen Verbindungen, Sapropelkohlen enthalten viel Aromaten. Bei der Verbrennung aromatischer Kohlenwasserstoffe entsteht Russ. Schwefel verbrennt zu Schwefeldioxid und –Trioxid. Organisch gebundener Brennstoffsauerstoff neigt zu Formaldehydbildung bei der Verbrennung. Organisch gebundener Brennstoffstickstoff erhöht die Wahrscheinlichkeit der Stickoxidbildung bei der Verbrennung.
Tabelle 1 zeigt die chemische Zusammensetzung fester Brennstoffe. In den Tabellen 2 und 3 sind die weltweit bekannten Steinkohlenreserven der Erde in den Jahren 1955 und 1986 zu sehen.
|
|
Wasser- Gehalt % |
Flüchtige Bestandteile % |
Brennbare Gase % |
Kohlenstoff (wasser- u. aschefrei) % |
Wasserstoff (wasser- u. aschefrei) % |
Sauerstoff (wasser- u. aschefrei) % |
Heizwert kJ/kg |
|
|
Holz |
35 – 45 |
80 - 85 |
40 - 45 |
45 – 50 |
5 – 7 |
40 – 43 |
17000 – 20000 |
|
|
Braun-
kohle |
Weichkohle |
45 – 60 |
70 – 50 |
10 - 25 |
65 – 70 |
5 – 9 |
18 – 30 |
25100 – 26800 |
|
Hartkohle (Pechkohle) |
10 – 30 |
64 – 45 |
15 - 35 |
70 – 75 |
5 – 6 |
12 – 18 |
26800 – 28500 |
|
|
Stein-
kohle |
Flammkohle |
4 – 7 |
40 – 45 |
35 - 40 |
75 – 82 |
5,8 - 6,0 |
> 9,8 |
bis 32850 |
|
Gasflammkohle |
3 – 6 |
35 – 40 |
30 - 35 |
82 – 85 |
5,6 - 5,8 |
9,8 - 7,3 |
bis 33900 |
|
|
Gaskohle |
3 – 5 |
28 – 35 |
25 - 30 |
85 – 87 |
5,0 - 5,6 |
7,3 - 4,5 |
bis 35000 |
|
|
Fettkohle |
2 – 4 |
19 – 28 |
17 - 24 |
87 – 89 |
4,5 - 5,0 |
4,5 - 3,2 |
bis 35400 |
|
|
Esskohle |
2 – 4 |
14 – 19 |
12 - 15 |
89 – 90 |
4,0 - 4,5 |
3,2 - 2,8 |
35400 |
|
|
Magerkohle |
1 – 3 |
10 – 14 |
9 - 12 |
90 - 91,5 |
3,75 - 4,0 |
2,8 - 2,5 |
bis 35600 |
|
|
Anthrazit |
< 2 |
6 – 10 |
5 - 9 |
> 91,5 |
< 3,75 |
< 2,5 |
bis 36000 |
|
Tabelle 1: Zusammensetzung fester Brennstoffe. Torf und Lignit liegen ihrer Zusammensetzung nach zwischen Holz und Braunkohle. Mit zunehmender Inkohlung steigt der Heizwert, der Kohlenstoffgehalt und sinken Wasser- und Sauerstoffgehalt und flüchtige Bestandteilen.
|
Steinkohlenreserven, Stand 1955 |
||
|
|
Reserve in Mio. T |
Reserve in1015 J |
|
Europa |
339188 |
9836452 |
|
Asien |
547880 |
15888520 |
|
UdSSR |
947000 |
27463000 |
|
Afrika |
72370 |
2098730 |
|
Nordamerika |
1608525 |
46647225 |
|
Südamerika |
4523 |
131167 |
|
Australien |
13650 |
395850 |
|
Total |
3591346 |
1.04149034 |
Tabelle 2: Welt-Steinkohlereserven, Stand 1955, Quelle: Új Magyar Lexikon, 1962
|
Steinkohlenreserven, Angaben in 1015 J, Stand 1986 |
|||
|
|
Reserve |
Förderung |
Reserve / Förderung [Jahr] |
|
Nordamerika |
3782335 |
22174 |
170 |
|
Lateinamerika |
75552 |
758 |
99 |
|
Westeuropa |
970291 |
8332 |
116 |
|
Naher Osten |
|
29 |
|
|
Afrika |
1833213 |
4149 |
442 |
|
Asien u. Australien |
1186733 |
9693 |
122 |
|
UdSSR |
3036608 |
15818 |
192 |
|
VR China |
4365124 |
22568 |
193 |
|
Osteuropa |
897083 |
14793 |
61 |
|
Total |
1.8146939 |
98315 |
184 |
Tabelle 3: Welt-Steinkohlereserven, Stand 1986, Quelle: The World Ressource Institute, 1988-89
Die Reserven haben sich trotz intensiver Förderung zwischen 1955 und 1985 beinahe verdoppelt, da mehr Kohle gefunden als verbraucht wurde.
Aufgabe 3: Welcher Anteil der gesamten Biomasse der Erde ist in Form von bekannten Welt-Steinkohlenreserven vorhanden? Entnehmen Sie die zu dieser Aufgabe benötigten Daten aus der Lösung der Aufgabe 1 und aus den Tabellen 2 und 3. Gehen Sie bei der Berechnung von einem Kohlenstoffgehalt der Steinkohle von 85 % aus (Mittelwert in Tabelle 1 für Steinkohle).
Aufgabe 4: Warum neigt die Kohlenverbrennung zu Russbildung?
Aufgabe 5: Warum neigt die Holzverbrennung zu Formaldehydbildung?
Erdöl
Umrechnungen: Der Energieinhalt von 1 t Erdöl entspricht etwa 1270 Nm3 Erdgas oder
1,5 t SKE bzw. 44×109 J. Die Mengenangabe erfolgt gelegentlich in Gallone (ca.
3,8 l) oder Barrel (Fass, ca. 159 l). Nach den bekannten „sicheren Reserven“
ist der weltweite Erdölbedarf etwa für 35 – 45 Jahre gedeckt. Die „Ressourcen„
d.h. geschätzten aber nicht nachgewiesenen Reserven liegen deutlich höher.
Auch Erdöl und Erdgas sind biogenen Ursprungs. Man vermutet, dass aus dem Meeresplankton und dem daraus entstandenen Faulschlamm unter Mithilfe von anaeroben Bakterien Kohlenwasserstoffverbindungen gebildet wurden. Unter dem Einfluss von hohem Druck und Erdwärme soll in Jahrmillionen Erdöl entstanden sein. Erdöl und Erdgas wurden schließlich in höhere Schichten verdrängt, bis sie an undurchlässige Ton- oder Salzschichten stießen.
Zusammensetzung: Erdöl (Petroleum, Rohöl, Steinöl, Bergöl) ist ein kompliziertes Gemisch von etwa 500 verschiedenen Kohlenwasserstoffen: Aliphaten, Naphthenen und Aromaten mit wechselnden Anteilen ungesättigter Kohlenwasserstoffe. Die Farbe ist wasserklar bis fast schwarz, grünlich fluoreszierend, sie sind viskos; Dichte zwischen 0,65 u. 1,02. Aufgrund neuerer Forschungen wird angenommen, dass sich das Erdöl in vorgeschichtlicher Zeit hauptsächlich aus tierischen Substanzen (Kohlenhydrate, Fette u. Eiweiße), z.B. aus dem Plankton (Faulschlamm), gebildet hat.
Die chemische Zusammensetzung schwankt je nach Fundort sehr stark: Vorkommen u.A. in Russland (Sibirien), USA (Pennsylvania), Saudi-Arabien, Mexiko, China, Großbritannien, Venezuela, Irak, Iran, Kuwait, Libyen, Norwegen, Rumänien, Kanada, Indonesien, Nigeria u. Ägypten; geringe deutsche Vorkommen in Niedersachsen (bei Hannover und im Emsland) und in Schleswig-Holstein. Aus dem Meeresboden und in Küstennähe erfolgt die Gewinnung von Bohrinseln aus. Das nach Anbohren der bis zu 6000 m tiefen erdölführenden Schichten entweder unter eigenem Druck an die Erdoberfläche tretende oder hochgepumpte Erdöl / Erdgas wird durch Pipelines zu den Raffinerien befördert und dort in oft vollautomatisch arbeitenden Anlagen einer fraktionierten Destillation unterworfen. Man destilliert dabei zunächst unter Normaldruck die bis etwa 200 °C siedenden Bestandteile ab, wobei Petrolether (Gasolin, Lösungsmittel) bei 40–70 °C, Leichtbenzin bei 70–90 °C, Petroleum (Schwerbenzin, für Düsenflugzeuge) bei 100–150 °C u. Ligroin (Lack-, Testbenzin) bei 100–180 °C gewonnen werden.
Der Rückstand wird im Vakuum destilliert, wobei man Leuchtpetroleum (Traktorentreibstoff) bei 200 bis 300 °C, Gasöle (Dieselöl, Haushaltsheizöl) bei 300–350 °C sowie Spindel-, Maschinen- u. Zylinderöle erhält. Die über 350 °C siedende Rückstände trennt man in Schmieröle, Vaseline, feste Paraffine u. Asphaltrückstände. Meist werden die höhersiedenden Öle durch einen gelenkten Crackprozess (katalytisches oder thermisches Cracken) in niedrigsiedende Bestandteile aufgespaltet, wodurch die Benzinausbeute größer wird.
|
Name der Fraktion |
Siedebereich [°C] |
Verwendung |
|
Petrolether / Gasolin |
40 - 70 |
Fleckenwasser / Lösungsmittel |
|
Leichtbenzin |
60 – 100 |
Vergaserkraftstoff |
|
Schwerbenzin |
100 – 150 |
Vergaserkraftstoff |
|
Ligroin |
120 – 150 |
Lösungsmittel/Waschbenzin |
|
Petroleum/Kerosin |
150 – 300 |
Beleuchtungsmittel |
|
Gasöl |
250 – 350 |
Dieselmotoren / Heizöl EL |
|
Schmieröl |
> 300 |
Maschinen-/Motorenöl |
|
Bitumen |
Rückstand |
Straßenbau/Dachpappe |
Tabelle 4: Die wichtigsten Erdölprodukte.
Man erkennt aus Tabelle 4, dass Dieselöl und Heizöl EL den gleichen Siedebereich aufweisen. Der unterschied zwischen diesen Brennstoffen besteht in einigen physikalischen (z.B. Viskosität, Stockpunkt) und chemischen Anforderungen (z.B. Schwefelgehalt).
Die Gefahren der Erdölproduktion und –Verbrauch sind:
a) 1 Liter Öl verseucht 1 Million Liter Wasser;
b) Ölschicht an der Wasseroberfläche ist luftundurchlässig;
c) Bodenverseuchung,
d) Feuer- und Explosionsgefahr.
Tabellen 5 und 6 zeigen die Welt-Rohölreserven und die Verfügbarkeit in den Jahren 1986 und 2000. In diesem Zeitraum stiegen die Reserven von 3,9 ×1021 Joule auf 6,1 ×1021 Joule und die Verfügbarkeit von 32 auf 39 Jahre. Zwar zeigen die Reserven und die Verfügbarkeit einen steigenden Charakter. Es muss jedoch darauf hingewiesen werden, dass ca. 80 % der Welt-Rohölreserven im Nahen Osten, d.h. in einer politisch unsicheren Region liegen.
|
Erdölrserven, Angaben in 1015 J, Stand 1986 |
|||
|
|
Reserve |
Förderung |
Verfügbarkeit: Reserve / Förderung [Jahr] |
|
Nordamerika |
213537 |
23845 |
9 |
|
Lateinamerika |
519188 |
13834 |
38 |
|
Westeuropa |
100488 |
8299 |
12 |
|
Naher Osten |
2294476 |
26772 |
86 |
|
Afrika |
305651 |
10501 |
29 |
|
Asien u. Australien |
104675 |
7449 |
14 |
|
UdSSR |
334960 |
25666 |
13 |
|
VR China |
100488 |
5468 |
19 |
|
Osteuropa |
12561 |
963 |
13 |
|
Total |
3.986024 |
122796 |
32 |
Tabelle 5 : Welt-Rohölreserven, Stand 1986, Quelle: The World Ressource Institute, 1988-89
|
Erdölreserven, Angaben in Mio. Tonnen, Stand 2000 |
||||
|
|
Reserve [Mio. Tonnen] |
Förderung [Mio. Tonnen] |
Verfügbarkeit [Jahr] |
Reserve [1015 J] |
|
Nordamerika u. Mexiko |
7.413 |
650,3 |
11 |
326172 |
|
Südamerika |
10.750 |
346,6 |
31 |
473000 |
|
Europa (West) |
2.272 |
332,9 |
7 |
99968 |
|
Naher Osten |
90.369 |
1.112 |
81 |
3.976236 |
|
Afrika |
8.113 |
360,7 |
22 |
356972 |
|
Frühere UdSSR |
7.754 |
394,5 |
20 |
341176 |
|
VR China |
3.288 |
160,8 |
20 |
144672 |
|
Sonstige Länder |
9.748 |
213,2 |
46 |
428912 |
|
Total |
139.707 |
3.571 |
39 |
6.147108 |
Tabelle 6: Welt-Rohölreserven, Stand 2000, Quelle: Mineralölwirtschaftsverband
(http://www.vebaoel.de/oel-welt/oel_fakten/oelreserven.html)
Ähnlich wie bei Kohle sind in der Vergangenheit die Reserven mit der Zeit ständig gewachsen
(siehe Abb. 5 und 6)
Aufgabe 6: 1 Liter Öl kann 1 Million Liter Wasser verseuchen. Wie ist es erklärbar, wenn das Öl in Wasser unlöslich ist?
Aufgabe 7: Was ist die Folge, dass die Ölschicht an der Wasseroberfläche luftundurchlässig ist?
Aufgabe 8: Was ist der wesentliche Unterschied zwischen Dieselöl und Heizöl?
Erdgas und Flüssiggas
Umrechnungen: Energieinhalt von 1000 Nm3 Erdgas » 0,79 t Öl » 1,18 t SKE » 34,6×109 J. Nach den bekannten „sicheren Reserven“ ist der
weltweite Erdgasbedarf etwa für 60 – 70 Jahre gedeckt. Die „Ressourcen„ d.h.
geschätzten aber nicht nachgewiesenen Reserven liegen deutlich höher.
Der Begriff Erdgas umfasst alle gasförmigen Kohlenwasserstoffverbindungen, die aus der Erde stammen und brennbar sind. Die Zusammensetzung von Erdgas kann variieren. Hauptbestandteile sind Methan (CH4), chemisch gesehen also eine organische Verbindung aus den Elementen Kohlenstoff ( C ) und Wasserstoff ( H ) mit einem Volumenanteil von 80 – 99 % und Ethan (C2H6) mit einem Anteil von 1 – 10 %. Weitere häufige Erdgaskomponenten sind: Stickstoff, Kohlendioxid, Propan(C3H8) und Butan(C4H10). Propan und Butan sind bei Umgebungstemperatur und Umgebungsdruck gasförmig, bei erhöhtem Druck sind sie flüssig (Flüssiggas).
Erdgas aus Kohle: Aus den Ablagerungen höherer Pflanzen entstanden Kohleflöze (Inkohlungsprozess). Vereinzelt sackten diese Kohleflöze in größere Erdschichten ab. Durch den Tiefendruck und die hohen Temperaturen kam es zu einer "Nachinkohlung", wobei sich Kohlenstoff anreicherte und andere Gase, wie z. B. Sauerstoff, Wasserstoff und Methan, verdrängt wurden. Diese Gase sammelten sich an und bildeten riesige Vorkommen.
Erdgas aus Ölschiefer: Durch hohe Temperaturen kann aus Ölschiefer in
einer Art Crackprozess Erdgas entstehen. Heutzutage bleiben diese Vorkommen
noch überwiegend unberücksichtigt, in der Zukunft können die Ölschiefervorkommen
jedoch an Bedeutung gewinnen.
Erdgas aus Erdöl: Aus Erdöl entweicht nach der Druckentspannung Methan, Ethan, Propan und Butan. Dieses Gemisch wird auch als „Nassgas“ bezeichnet, im Gegensatz zu der Mischung aus Methan und Ethan (Trockengas). Durch technologische Trennung gewinnt man aus dem Nassgas Trockengas und Flüssiggas (Propan, Butan oder eine Mischung aus Propan und Butan).
|
Erdgasreserven, Angaben in 1015 J, Stand 1986 |
|||
|
|
Reserve |
Förderung |
Verfügbarkeit Reserve / Förderung [Jahr] |
|
Nordamerika |
310720 |
19654 |
16 |
|
Lateinamerika |
213620 |
2835 |
72 |
|
Westeuropa |
240808 |
6511 |
36 |
|
Naher Osten |
1013724 |
2010 |
500 |
|
Afrika |
221388 |
1792 |
130 |
|
Asien u. Australien |
217504 |
3894 |
54 |
|
UdSSR |
1705076 |
25851 |
66 |
|
China |
31072 |
494 |
65 |
|
Osteuropa |
15536 |
2629 |
6 |
|
Total |
3.969448 |
65669 |
60 |
Tabelle 7a : Welt-Erdgasreserven, Stand 1986, Quelle: The World Ressource Institute, 1988-89
|
Erdgasreserven, Stand 1993 |
||
|
|
Reserve in Mrd. m³ |
Reserve in 1015 J |
|
UdSSR |
56500 |
1954900 |
|
USA |
4700 |
162620 |
|
Kanada |
2700 |
93420 |
|
Niederlande |
1900 |
65740 |
|
GB |
600 |
20760 |
|
Indonesien |
1800 |
62280 |
|
Algerien |
3600 |
124560 |
|
Saudi Arabien |
5300 |
183380 |
|
Norwegen |
2000 |
69200 |
|
Mexiko |
2000 |
69200 |
|
Venezuela |
3700 |
128020 |
|
Iran |
20700 |
716220 |
|
Argentinien |
800 |
27680 |
|
Deutschland |
300 |
10380 |
|
China |
1700 |
58820 |
|
Total |
142000 |
4.913200 |
Tabelle 7b : Welt-Erdgasreserven, Stand 1993, Quelle: Brockhaus Enzyklopädie, 2001. Die Reserven sind ähnlich wie bei Kohle und Rohöl in der Vergangenheit ständig gewachsen.
Tabellen 7a und 7b zeigen die Entwicklung der Welt-Erdgasreserven. Energiebezogen sind die Welt-Erdgas und Welt-Erdölreserven in etwa gleich. Die Gasreserven sind jedoch territorial viel gleichmäßiger verteilt als die Ölreserven. Bezogen auf gleiche Kohlendioxidfreisetzung wird bei Erdgas mehr Energie freigestellt als bei allen anderen fossilen Brennstoffen.
Brennstoffvorräte
Die Tabellen 2, 3 und 5 – 7 zeigen, dass in der Vergangenheit die Energiereserven der Erde ständig zugenommen haben. Dies ist der Fall, wenn in einem Zeitraum mehr Lagerstätten gefunden als verbraucht werden. Bei den Lagerstätten fossiler Brennstoffe unterscheidet man zwischen Reserven (oft sichere Reserven genannt) und Ressourcen (unsichere Reserven)
Reserven: Die Brennstoffmenge der Reserven ist durch geologische Vermessungen genau bekannt. Nur solche Lagerstätten werden zu den Reserven gezählt, deren Abbau wirtschaftlich rentabel ist. Bei sinkenden Rohölpreisen sinkt die als Reserve definierte Brennstoffmenge, da durch die niedrigen Preise weniger Brennstoff wirtschaftlich abbaubar ist. Entsprechend steigt die Brennstoffmenge der Reserven bei steigenden Energiepreisen.
Ressourcen: Zu den Ressourcen zählen Lagerstätten, deren Abbau bei den aktuellen Brennstoffpreisen wirtschaftlich nicht rentabel ist, ferner solche, deren Brennstoffmenge nur geschätzt werden kann, weil zu einer genauen Mengenangabe noch nicht hinreichend viele Messbohrungen vorhanden sind. Bei allen fossilen Brennstoffen ist die als Ressource angegebene Brennstoffmenge ca. acht bis zehnmal höher als die der Reserven.
Verfügbarkeit [Reserve / (jährliche Förderung)]: In den vergangenen 100 Jahren haben sich sowohl die Reserven als auch die Ressourcen vervielfacht, da mehr Brennstoff gefunden als verbraucht wurde. Bei steigenden Reserven und steigender Förderung ergab sich im vorigen Jahrhundert eine etwa konstante oder langsam zunehmende Verfügbarkeit. Die auf die Weltreserven bezogene Verfügbarkeit beträgt für Rohöl gegenwärtig ca. 30 – 40 Jahre, für Erdgas ca. 80 Jahre und für Steinkohle ca. 200 Jahre. Da die Vermessung der Lagerstätten kostspielig ist, bleibt der Zeitraum der gesicherten Verfügbarkeit der fossilen Brennstoffe auf wenige Jahrzehnte beschränkt. Die Verknappung fossiler Brennstoffe ist weniger darin zu sehen, dass keine Lagerstätten mehr gefunden werden, sondern darin, dass Neufunde oft an geographisch schwer zugängigen Orten (z.B. Tiefsee, Polargebiet) oder an politisch unstabilen Regionen (z.B. Naher Osten) liegen.
Aufgabe 9: Warum sind die Welt-Rohölreserven während des Zweiten Weltkrieges gesunken und während des Arabisch-Israelischen-Krieges 1973 gestiegen?
Der Trend, dass immer mehr Reserven an fossilen Brennstoffen gefunden als verbraucht werden, ist in den vergangenen Jahrzehnten umgekippt. Die globale Versorgung ist zwar für Jahrzehnte gesichert, die neuen Funde sind jedoch zunehmend schwer abbaubar.

Abbildung 1: Weltweite Ölreserven und –verbrauch; Quelle: Oil & Gas J., Stand 2001
Aus heutigem Stand können in den kommenden Jahrzehnten die weltweiten Ölreserven knapp werden. Die Gasversorgung scheint etwas längerfristig gesichert zu sein. Der sicherste fossile Energieträger bleibt jedoch die Kohle. (Abb. 2.)

Abbildung 2: Fossile Energiereserven; Quelle: Bundesanstalt für Geowissenschaften und Rohstoffe, 1963
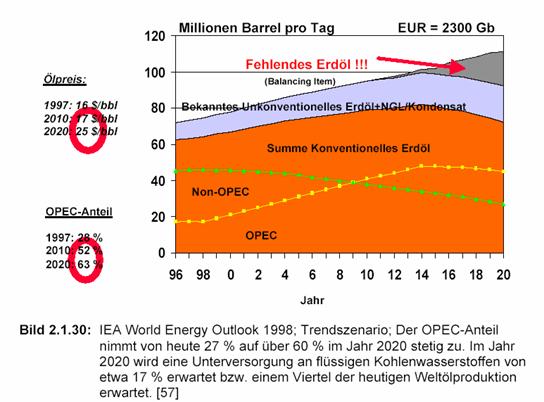
Abbildung 3: Warnung von einer Unterversorgung an flüssigen Kohlenwasserstoffen aus europäischer Sicht; Quelle: Endbericht Vorstudie im Auftrag des Deutschen Bundestages, Büro für Technikfolgenabschätzung (TAB); D-85521 Ottobrunn, Jörg Schindler, Werner Zittel, 2001
![]()

Abbildung 4: Zunehmende Anstrengungen für Aufrechterhaltung der Energieversorgung; Quelle: siehe Abbildung 3.
Für die kommenden Jahrzehnte scheint die Versorgung an fossilen Brennstoffen gesichert zu sein. Eine eventuelle Verknappung kann eher bei flüssigen Brennstoffen auftreten. Als größte Unsicherheit wird durch die politische Unstabilität der Förderländer angesehen (Abb. 5)
Abbildung 5

Quelle siehe Abbildung 3.
Aufgabe 10: Zeigen Sie anhand der Abbildungen dieses Kapitels, dass für die Kommende Generation eine Verknappung fossiler Brennstoffreserven zu befürchten ist.
Nachwachsende Brennstoffe
Die Anwendung erneuerbaren oder regenerativen Energien belastet nicht die Atmosphäre mit Treibhausgasen. Als erneuerbare Energien werden a) Geothermische Energie, b) Windenergie, c) Sonnenenergie, d) Wasserkraft und e) Bioenergie bezeichnet. Die zukünftige Bedeutung der Bioenergie steigt eher aus umweltpolitischen Gründen als wegen der tatsächlichen Erschöpfung der Vorräte steigen. Nachwachsende Brennstoffe belasten deutlich geringer die Umwelt mit Kohlendioxid als fossile Brennstoffe.
Schon heute könnte der gesamte Energiebedarf durch regenerative Energien gedeckt werden. Wie Tabelle 8 zeigt, hat die Sonnenenergie hierbei das höchste Potential.
|
Energieform |
mögliche Deckung |
heute technisch nutzbar |
|
|
|
Die Zahlen geben das x-Fache des Weltenergiebedarfs an. |
||
|
direkte Sonnenenergie |
2.850 |
3,8 |
|
|
Windenergie |
200 |
0,5 |
|
|
Biomasse |
20 |
0,4 |
|
|
Erdwärme |
5 |
1,0 |
|
|
Meeresenergie |
2 |
0,05 |
|
|
Wasserkraft |
1 |
0,15 |
|
|
Gesamt: |
3.078 |
5,9 |
|
Tabelle 8: Mögliche Deckung des Weltenergiebedarfs durch erneuerbare Energien. Quelle: Forschungsverbund Sonnenenergie (FVS/Berlin)
Aus Tabelle 8 ist zu entnehmen, dass der gesamte Weltenergiebedarf 3.078 Mal durch regenerative Energiequellen gedeckt werden kann. In Deutschland wurde 1999 neun Prozent des Strombedarfs erneuerbare Energie abgedeckt.
 |
Abbildung 6: Aufkommen biogener Rest- und Abfallstoffe in Deutschland im Jahr 1999; Quelle: L. Lieble, Biomasse als Energieträger, BWK 11/2003
Abbildung 6 zeigt Aufteilung des Bioenergieaufkommens in Deutschland im Jahr 1999. Etwa ein Fünftel dieser Energiequelle ist der Brennholz.
Für den Einsatz von Brennholz als Energieträger liegen mangels ausreichender statistischer Grundlage keine zuverlässigen Mengenangaben vor. Die EU-Kommission kündigt an, den Anteil erneuerbarer Energien am Primärenergieverbrauch in der EU von derzeit etwa 6 % (davon Biomasse ca. 3 %) bis zum Jahr 2010 zu verdoppeln. In Deutschland soll bis zum Jahr 2010 der Anteil erneuerbarer Energien am Primärenergieverbrauch von heute 2 % auf 4 % verdoppelt werden. Bis zum Jahr 2050 sollen 50 % der Primärenergie regenerativ erzeugt werden.
Eine Prognose über das potentielle Rohholzaufkommen in Deutschland bis zum Jahr 2020 der Bundesforschungsanstalt für Forst- und Holzwirtschaft (BFH) hat gezeigt:
In unseren Wäldern sind genügend Ressourcen vorhanden, um nachhaltig Rohholz in steigendem Umfang bereitzustellen. Die Gesamtmenge des nachhaltig verfügbaren Rohholzaufkommens wird auf jährlich ca. 58 Mio. m3 geschätzt. Bisher wurden davon nur rund 70 % eingeschlagen. Selbst bei Ausschöpfung des errechneten nachhaltigen Gesamtaufkommens ergäbe sich wegen der Einhaltung eines Sicherheitsabstands zur maximalen Holzproduktion in den Wäldern noch eine Vorratsanreicherung von durchschnittlich ca. 1,5 m3 pro ha und Jahr. Der gegenwärtige Holzverbrauch beträgt etwa 1,1 m3 Pro ha und Jahr. (Quelle: Bundesforschungsanstalt für Forst- und Holzwirtschaft, BML 532)
Maßeinheiten für Brennholz
1 Festmeter (fm) = 1 m³ feste Holzmasse
1 Raummeter (rm) = 1 m³ geschichtete Holzteile inkl. Luftzwischenräume
1 Schüttraummeter (Srm) =1 m³ geschüttete Holzteile (Stückholz, Hackgut, usw.)

Tabelle 9: Umrechnung der Maßeinheiten für Brennholz. Quelle: Bundesforschungsanstalt für Forst- und Holzwirtschaft, BML 532
|
Feuchte [%] |
Fichte |
Laubholz |
Schlagbaum |
|
100 |
450 - 550 kWh/Sm3 |
800 - 900 kWh/Sm3 |
350 - 500 kWh/Sm3 |
|
75 |
500 - 600 kWh/Sm3 |
850 - 950 kWh/Sm3 |
400 - 550 kWh/Sm3 |
|
50 |
550 - 650 kWh/Sm3 |
900 - 1’000 kWh/Sm3 |
450 - 600 kWh/Sm3 |
|
25 |
600 - 700 kWh/Sm3 |
950 - 1'050 kWh/Sm3 |
500 - 650 kWh/Sm3 |
|
Sm3 = Schnitzelkubikmeter (Schüttraummeter); |
|||
|
100 % Feuchte entspricht dem „waldfrischen“ Holzschlag |
|||
Tabelle 10: Heizwert von Brennholz. Quelle: Bundesforschungsanstalt für Forst- und Holzwirtschaft, BML 532
Aufgabe 11: Die Gesamtmenge des nachhaltig verfügbaren Rohholzaufkommens wird auf jährlich ca. 58 Mio. m3 (Festmeter) geschätzt. Bisher wurden davon nur rund 70 % eingeschlagen. Rund 38 Millionen Tonnen leichtes Heizöl sind 1996 in Deutschland verbraucht worden. Wie viel von diesem Heizöl könnte durch Brennholz ersetzt werden, wenn man das ganze verfügbare Holzaufkommen einschlägt und die Hälfte davon als Brennholz verbraucht? Gehen Sie aus einem Mix von 1/3 Fichte, 1/3 Laubholz und 1/3 Schlagbaum bei je 50 % Feuchte aus. Gehen Sie bei den Umrechnungen aus
Festmeter – Schüttraummeter bei Stückholz,
Heizwert von Heizöl 10 kWh/Liter und
Heizöldichte von 830 kg/m3 aus.
Aufgabe 12: Stellen sie die Reihefolge auf, welche Heizung den Treibhauseffekt mehr verstärkt bei einem Stromverbrauch mit Heizstrom-Mix gemäß Tabelle 11.
A) Wärmepumpe mit Umgebungsluft als Wärmequelle, Jahresleistungszahl 2,5;
B) Wärmepumpe mit Grundwasser als Wärmequelle, Jahresleistungszahl 5,0;
C) Ölzentralheizung, Jahresnutzung 0,7, Stromverbrauch 3 % der Heizwärme;
D) Ölbrennwertnutzung, Jahresnutzung 0,95, Stromverbrauch 7 % der Heizwärme;
E) Gasheizung (Erdgas H), Jahresnutzung 0,7, Stromverbrauch 2 % der Heizwärme;
F) Gasbrennwertnutzung, Jahresnutzung 0,95, Stromverbrauch 7 % d. Heizwärme;
G) Holzpelletsheizung, Jahresnutzung 0,7, Stromverbrauch 5 % der Heizwärme;
H)
Brennholzheizung, Jahresnutzung 0,6, kein Stromverbrauch.

1) Vorgelagerte Kette für die Endenergie bis Übergabe im Gebäude inkl. Materialaufwand für Wärmeerzeuger, ohne Hilfsenergie im Haus 2) Bezugsgröße: unterer Heizwert Hu 3) Stromgutschrift für Kohlestrom 4) Der regenerative Anteil beinhaltet auch sekundäre Ressourcen, z.B. Restholz und Müll; Fernwärmeversorgung durch Steinkohle-Kondensationskraftwerk(=Anteil KWK) + Heizöl-Spitzenkessel; Nahwärmeversorgung durch Erdgas-BHKW (=Anteil KWK) + Erdgas-Spitzenkessel
Tabelle 11: Vergleich des kumulativen Energieaufwands verschiedener Energieträger. Quelle: IWU Institut Wohnen und Umwelt, Marc Großklos
Aufgabe 13: Folgende Tabelle zeigt die Kohlendioxid-Emission für Brennholz- und Heizölfeuerung. Berechnen Sie die fehlenden Angaben in der Tabelle unter der Voraussetzung, dass der Wärmebedarf wahlweise mit Holz und/oder mit Heizöl abgedeckt wird. Der Bezugswert für den Wärmebedarf ist die Energie, die bei der Verbrennung von 1000 kg Holz verwertet werden kann. Der Kohlenstoffgehalt des Heizöls ist 86 %. Die CO2-Emission der Brennstoffaufbereitung beider Brennstoffe beträgt 1 kg CO2 je kWh Energiebedarf. Die anzuwendenden Atom- und Molekulargewichte sind: C = 12, O2 = 32.
|
Material |
Holz |
Heizöl |
|
vergleichbare Brennstoffmenge |
1000 kg |
a kg |
|
Heizwert |
11,9 MJ / kg |
42,7 MJ / kg |
|
Wirkungsgrad: η |
70 % |
85 % |
|
Energiebedarf der Aufbereitung |
0,34 MJ / kg Holz |
10,9 MJ / kg Heizöl |
|
CO2-Emission je kg Brennstoff ohne Aufbereitung |
0 kg CO2 aus Holz (regenerative Energie!!) |
b kg CO2 aus Heizöl |
|
CO2-Emission der Aufbereitung |
c kg CO2 / kg Holz |
d kg CO2 / kg Heizöl |
|
CO2-Emission je kg Brennstoff incl. Aufbereitung |
e kg CO2 / kg Holz |
f kg CO2 / kg Heizöl |
|
CO2-Emission je MJ Nutzenergie incl. Aufbereitung |
g kg CO2 / MJ Nutzenergie |
h kg CO2 / MJ Nutzenergie |
|
CO2-Emission äquivalent zu 1000 kg Brennholz, incl. Aufbereitung |
j kg CO2 |
k kg CO2 |
Aufgabe 14: Berechnen Sie aus folgender Abbildung den Brennstoffanteil für Heizung und Warmwasserbereitung unter der Annahme, dass der 1-%-Anteil für (Kohle/Holz) sich
a) lediglich auf Kohlenfeuerungen (Steinkohle nach Tabelle 11), und
b) lediglich auf Holzfeuerungen (Brennholz nach Tabelle 11) bezieht.


Quelle: Stadt Gütersloh, FB Umweltschutz; Bearbeitet durch ©UMBLICK, September 2000
Aufgabe 15 Die Rohstoffreserven sind eine variable Größe. Weshalb?
Aufgabe 16 Die Primärenergieversorgung der Welt wird heute zu etwa 80% von
3 Energieträgern getragen. Diese sind
1. ..................................... 2. ................................... 3. .......................................
Aufgabe 17 Erdgas bildet sich oft zusammen mit Erdöl, es kann aber auch durch die Entgasung von ....................................-lagerstätten entstehen.
Aufgabe 18 Voraussetzungen die erfüllt sein müssen, damit Kohlenlagerstätten entstehen können.
1. .....................................................................................................................
2. .....................................................................................................................
3. .....................................................................................................................
Aufgabe 19 Steinkohlen sind in der Regel jünger, härter,
energiereicher, wasserhaltiger als Braunkohlen. (Streichen Sie die falschen Angaben!)
Brennstoffchemie
Aliphatische Verbindungen (aliphos = fett) sind kettenförmige Kohlenwasserstoffe.
Alkane oder Paraffine (parum affine = geringe Affinität) sind gesättigte Aliphaten. Der Paraffingehalt von Heizöl liegt bei ca. 60 – 80 %. Olefine (Alkene, Alkine) sind hingegen ungesättigte aliphatische Verbindungen. Der Olefingehalt von Heizöl liegt in der Regel unter 5 %.
Naphtene oder alizyklische Kohlenwasserstoffe sind ringförmige Kohlenwasserstoffe. Der Naphtengehalt vom Rohöl liegt in der Regel bei 5 %, beim russischen Öl liegt er häufig darüber, bei amerikanischem darunter. Naphtene haben in der Molekularstrucktur eine höhere Bindungsspannung als Paraffine und besitzen daher einen höheren Heizwert.
Aromaten oder Zyklische Kohlenwasserstoffe sind Verbindungen, deren Molekülstruktur sich vom Benzol ableitet. Der Aromatengehalt von Heizöl liegt in der Regel unter
30 %. Polyaromatische Kohlenwasserstoffe (PAK) zählen ebenfalls zu den Aromaten. Der PAK-Gehalt von Rohöl liegt in der Regel unter 10 %. Die angegebenen Gehalte schwanken von Lagerstätte zu Lagerstätte. Der Aromaten- und PAK -Gehalt von Steinkohle, insbesondere der von Sapropelkohle, liegt deutlich höher als der von Rohöl.
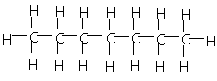
Alkane (Methan, Ethan, Propan, Butan, Pentan, Hexan, Oktan, etc.); Summenformel: CnH2n+2 Die gesättigten Aliphaten sind die Hauptkomponente von Erdöl und Erdgas. Sie haben eine hohe Zündtemperatur, niedrige Flammengeschwindigkeit, bei guter Aufbereitung und richtigem Temperaturmanagement ermöglichen sie eine sehr gute Verbrennung. Die C – C – C –Bindung der Alkane weist einen Tetraederwinkel von 109,5 ° auf. Dieser „ideale Tetraederwinkel“ hat eine Auswirkung auf die physikalischen und chemischen Stoffdaten wie Verbrennungswärme, Schmelzpunkt, Wärmeausdehnungskoeffizient, etc.
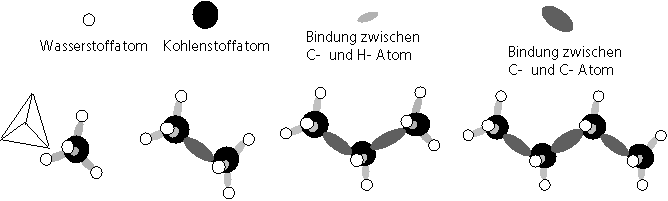
 |
Methan CH4 Ethan
C2H6 Propan C3H8
Butan C4H10
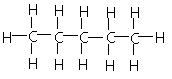

Pentan C5H12 Hexan C5H12 Heptan C6H14


![]()

![]()
Oktan (Noramal-Oktan) C8H18 Isooktan (2,2,4 Trimetilpentan) C8H18
Das Isooktan-Molekül ist viel kompakter als das Oktanmolekül, daher kann es schwerer aufgespaltet und gezündet werden. Dies führt zur Erhöhung der Zündtemperatur:
Noramal-Oktan = 206 °C, Isooktan = 417 °C,
Normal-Heptan = 285 °C, Benzol = 498 °C.
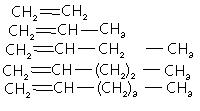 Alkene sind Olefine,
die eine ungesättigte Verbindung, eine Doppelbildung aufweisen. In der Regel
senkt eine Doppelbildung die Zündtemperatur, hebt die Flammengeschwindigkeit
und erhöht die Neigung zur Russbildung. (Ethen, Propen, Buten, Penten, Hexen,
Okten, etc.); Summenformel: CnH2n Alkene sind in geringer
Konzentration im Rohöl vorhanden. Alkene entstehen bei Krackprozessen und bei
der Pyrolyse; Alkene haben einen niedrigeren Zündpunkt als Paraffine. Bei der
Verbrennung neigen sie zu Polymerisation und dadurch zu Russbildung. Alkene
(Olefine) haben eine C=C- Doppelbildung, welche bei der Verbrennung die Russbildung
fördert. Die C=C- Doppelbildung ist sehr reaktionsfreudig, daher haben
Alkene eine niedrigere Zündtemperatur als Alkane. Die Reaktionsfreudigkeit
bedeutet jedoch nicht automatisch eine gute Verbrennung: An die Stelle mit
Doppelbildung können sich andere Kohlenwasserstoffketten anlagern (Polymerisation).
Die so gebildeten Riesenmoleküle können äußerst stabil sein (z.B. Russ) und die
Feuerungsanlage als unverbrannte Kohlenwasserstoffe verlassen.
Alkene sind Olefine,
die eine ungesättigte Verbindung, eine Doppelbildung aufweisen. In der Regel
senkt eine Doppelbildung die Zündtemperatur, hebt die Flammengeschwindigkeit
und erhöht die Neigung zur Russbildung. (Ethen, Propen, Buten, Penten, Hexen,
Okten, etc.); Summenformel: CnH2n Alkene sind in geringer
Konzentration im Rohöl vorhanden. Alkene entstehen bei Krackprozessen und bei
der Pyrolyse; Alkene haben einen niedrigeren Zündpunkt als Paraffine. Bei der
Verbrennung neigen sie zu Polymerisation und dadurch zu Russbildung. Alkene
(Olefine) haben eine C=C- Doppelbildung, welche bei der Verbrennung die Russbildung
fördert. Die C=C- Doppelbildung ist sehr reaktionsfreudig, daher haben
Alkene eine niedrigere Zündtemperatur als Alkane. Die Reaktionsfreudigkeit
bedeutet jedoch nicht automatisch eine gute Verbrennung: An die Stelle mit
Doppelbildung können sich andere Kohlenwasserstoffketten anlagern (Polymerisation).
Die so gebildeten Riesenmoleküle können äußerst stabil sein (z.B. Russ) und die
Feuerungsanlage als unverbrannte Kohlenwasserstoffe verlassen.
C2H4 Ethen (Ethylen)
C3H6 Propen (Propylen)
C4H8 Buten (Butylen)
C5H10 Penten
C6H12 Hexen
Alkine sind Olefine, die eine so genannte Dreifachbildung aufweisen. In der Regel senkt eine Dreifachbildung die Zündtemperatur, hebt die Flammengeschwindigkeit und erhöht die Neigung zur Russbildung noch stärker als eine Doppelbildung. (Ethin [Acetylen], Propin, Butin, Pentin, Hexin, Oktin, etc.) Summenformel: CnH2n-2 Alkine sind gelegentlich in geringer Konzentration im Rohöl vorhanden. Alkine entstehen bei Krackprozessen und bei der Pyrolyse; Sie haben einen hohen Heizwert, sehr niedriger Zündpunkt und weisen eine sehr starke Neigung zur Russbildung auf. Alkine haben eine CºC- Dreifachbildung. Die CºC-Bindung ist noch reaktionsfreudiger als die C=C- Doppelbildung. Daher haben Alkine eine besonders niedrige Zündtemperatur und
neigen extrem stark zur Russbildung.
C2H2 CHºCH Ethin (Azetylen) Russbaustein !
C3H4 CHºC-CH3 Propin (Ethylazetylen)
C4H6 CHºC-CH2 -CH3 Butin (Propylazetylen)
C5H8 CHºC-(CH2)2-CH3 Pentin (Butylazetylen)
C6H10 CHºC-(CH2)3-CH3 Hexin (Pentylazetylen)
Alizyklische Verbindungen (zyklisierte aliphatische Verbindungen, Naphtene);
Summenformel: CnH2n. Cycloparaffine oder Cycloalkane sind in ihren Verbrennungseigenschaften den aliphatischen Paraffinen sehr ähnlich. Im Erdöl kommen Fünf- und Sechsringe sehr häufig vor, insbesondere im irakischen, iranischen und kaukasischen Erdöl. Alizyklische Verbindungen besitzen die gleiche Summenformel wie Alkene (CnH2n). Ihre chemischen Eigenschaften und damit ihre Verbrennungseigenschaften gleichen jedoch denen der Alkane mit der Summenformel (CnH2n+2). Bei der Bildung der alizyklischen Moleküle treten Spannungen auf. Diese Spannung ist am geringsten bei den Molekülen mit 5 – 8 Kohlenatomen. In der Natur kommen nur die 5 – 8-kettigen Moleküle vor. Die Bindungsspannung erhöht den Brennwert. Die Brennwerterhöhung kann je nach der Bindungsspannung 10 % erreichen.
 |
Die alizyklischen C-C-Bindungen haben einen kleineren Bindungswinkel als die Alkane. Die Verkleinerung der Bindungswinkel erzeugt eine Spannung, die Spannungsenergie erhöht die Verbrennungswärme und verändert einige physikalische Eigenschaften. So ist z.B. die massebezogene Verbrennungswärme von Cyklopropan um ca. 10 % höher als die von Propen, bzw. um ca. 6 % höher als die von Cyklohexan.
Aromatische Verbindungen Summenformel: CnHm mit m £ n. Beispiele: Benzol und Benzolderivate, Aromatische Verbindungen sind Bestandteile von Rohöl und Sparopel-Kohle. (Sapropelkohlen entstanden durch Verkohlung von Faulschlamm, sie bilden meist Einlagerungen von Humuskohlen). Die Aromaten neigen bei der Verbrennung besonders stark zur Russbildung.
 |
Die Umwandlung von Ethin in Benzol:
3 Ethin = 1 Benzol
3 (C2H2) Þ C6H6
Die häufigsten Schreibweisen für Benzol sind:
 |
Aus Benzol entstehen durch Polymerisation polyzyklische Verbindungen, die bei der Verbrennung noch stärker zur Russbildung neigen als einfache Aromaten. Benzolmoleküle sind Russbausteine:
 Russ
Russ
Fulleren (Fußballmolekül) sind reine Kohlenstoffmoleküle, die die
Form einer Kugel, Röhre oder eines Ringes aufweisen. Ähnliche
Strukturen können Russmoleküle annehmen. Sie beinhalten einige
hundert bis tausend Kohlenstoffatome und wenige Wasserstoffatome.
 |
Graphitkristall. Ähnliche Struktur weisen Russmoleküle auf.
Russmoleküle sind Riesenmoleküle mit der Summenformel CnHm mit m << n.
Sie entstehen durch Polymerisation von Alkenen, Alkinen und Aromaten.
Entstehung von Ethylradikalen bei Kracken, Pyrolyse und Luftmangelverbrennung:
- [CH2 – CH2]n - Þ n (CH2 = CH2) Þ n H2 + n (CH º CH)
Russbildung und Russabbau: Zyklische Verbindungen sind Bausteine für Polyzyklische Verbindungen. Russmoleküle sind in der Regel polyzyklische Moleküle. Bei Pyrolyse und bei Luftmangelverbrennung von zyklischen Verbindungen verläuft die Russbildung oft schneller als die Oxidation selber. Hat sich einmal bei der Verbrennung Russ gebildet, wird für den Russabbau in der Flamme bei hoher Flammentemperatur und Verweilzeit ein hoher Luftüberschuss benötigt. Bei Ethinverbrennung (Schweißflamme) ist die Russbildung gewollt, um den Karbongehalt der Schweißnaht zu steigern. Zur Vermeidung der Russbildung müssen in der Flamme auch lokale Luftmangelbereiche vermieden werden. Daher fördert die Stufenverbrennung (z.B. zur Vermeidung der NO-Bildung) aromathaltiger Brennstoffe die Russbildung.
Heterozyklische Verbindungen
Eine oder einige C-Atome sind in den Kohlenstoffringen durch andere Atome wie Stickstoff (N), Sauerstoff (O), Phosphor (P) oder Schwefel (S) ersetzt. Diese werden „organisch gebundener“ Stickstoff, Sauerstoff etc. genannt. Brennstoffstickstoff erhöht die Neigung der Stickoxidbildung bei der Verbrennung. Chemisch gebundener Sauerstoff erhöht die Neigung zur Formaldehydbildung, insbesondere bei der Verbrennung mit hohem Luftüberschuss. Brennstoffschwefel führt bei der Verbrennung zu Schwefeldioxidbildung. Stickoxide und Schwefeloxide tragen zu Versauerung von Niederschlägen und Böden bei. Die organischen Naturstoffe sind heterolzyklische Verbindungen.
Organische Naturstoffe sind heterozyklische Verbindungen
Die organischen Naturstoffe sind Kohlenhydrate (Zucker, Stärke, Cellulose), Lignin (Holz ist eine Mischung aus Zellulose, Lignin u.A.), Alkohole, Öle, Fette, organische Säuren, Eiweiß, etc. Sie bestehen aus Aliphaten, Aromaten, azyklischen und heterozyklischen Verbindungen. Die biologische Masse ist die Summe der organischen Naturstoffe, während die fossilen Brennstoffe die Umwandlungsprodukte früherer biologischer Massen darstellen. Alkohole sind gesättigte oder ungesättigte organische Verbindungen mit vergleichsweise niedriger Viskosität, die wenigstens eine OH-Gruppe aufweisen. Bei der Verbrennung mit hohem Luftüberschuss neigen sie zu Formaldehydbildung. Fette sind organische Verbindungen, die wenigstens eine COOH-Gruppe aufweisen, und derer Schmelzpunkt unterhalb der Raumtemperatur liegt. Bei der Verbrennung neigen sie zur Russbildung. Organische Öle unterscheiden sich von den Fetten lediglich in ihrem niedrigeren Schmelzpunkt, daher sind sie als Flüssigbrennstoff besser geeignet als Fette. Wegen hohem Anteil an ungesättigten Bestandteilen neigen Pflanzenöle bei der Verbrennung zur Russbildung. Pflanzenöle haben eine höhere Viskosität als Heizöl EL. Dies führt zu Schwierigkeiten bei der Zerstäubung, was die höhere Neigung zur Russbildung zusätzlich verstärkt. Kohlenhydrate (Zucker, Stärke, Cellulose, Lignin, etc.) Bei kleineren Molekülen (z.B. Zucker) neigen sie zur Formaldehydbildung, bei größeren Molekülen (z.B. Cellulose und Lignin) zur Russbildung. Zucker und Stärke werden meist in Alkohole umgewandelt für die Verbrennung.
Metallanteil von Brennstoffen und Öladditive
Bei festen Brennstoffen können die mineralischen Bestandteile, darunter auch Metalloxide, die Zehnprozentgrenze übertreffen. Bei der Verbrennung bilden sie Asche. Der Aschengehalt der flüssigen Brennstoffe ist im Bereich 0,1 – 0,5 %. Die metallischen Bestandteile beeinflussen die Verbrennung wie folgt: Einige Metalle (z.B. Vanadium) dienen als Katalysator und beschleunigen die Oxidation. Dadurch können sie die Russbildung reduzieren und die Stickoxidbildung fördern. Sie bewirken ferner, dass ein erhöhter Anteil des Brennstoffschwefels zu Schwefeltrioxid (anstatt zu –Dioxid) verbrennt. Die gleiche Wirkung zeigen Additive, die zwar die Russbildung reduzieren, dafür aber als Nebenwirkung die Anlagenkorrosion beschleunigen.
Tabelle 1 zeigt die Zusammensetzung der wichtigsten festen Brennstoffe. Aus Tabelle 12 ist die Zusammensetzung der im Verbundnetz am häufigsten zum Einsatz kommenden Gase zu entnehmen. Die Tabellen 13 und 14 zeigen die Zusammensetzung und Kennzahlen der wichtigsten flüssigen und gasförmigen Brennstoffe.
|
|
|
Verbund-Erdgas Nord ~ Erdgas H |
Russisches Erdgas ~ Erdgas H |
Erdgas L |
|
Methan CH4 |
Vol.-% |
90,02 |
97,25 |
81,8 |
|
Ethan C2H6 |
Vol.-% |
4,80 |
1,25 |
2,8 |
|
Propan C3H8 |
Vol.-% |
0,74 |
0,48 |
0,4 |
|
Butan C4H10 |
Vol.-% |
0,21 |
0,09 |
0,2 |
|
Kohlendioxid CO2 |
Vol.-% |
1,03 |
0,06 |
0,8 |
|
Stickstoff N2 |
Vol.-% |
3,13 |
0,85 |
14 |
|
Brennwert Hs,n |
kWh/m³ |
11,21 |
11,18 |
10,3 |
|
Heizwert Hi,n |
kWh/m³ |
10,12 |
10,08 |
9,3 |
|
Dichteverhältnis |
- |
0,61 |
0,57 |
0,638 |
|
oberer Wobbeindex |
kWh/m³ |
14,32 |
14,78 |
12,9 |
Tabelle 12 Zusammensetzung der am häufigsten zum Einsatz kommenden Brenngase
|
Zusammensetzung |
Heizöl |
Erdgas L |
Erdgas H |
|
Gew.-% |
Vol.-% |
Vol.-% |
|
|
Kohlenstoff (C) |
86 |
|
|
|
Wasserstoff (H) |
13 |
|
|
|
Stickstoff (N) |
0,5 |
14 |
1 |
|
Schwefel (S) |
0,3 |
|
|
|
Methan (CH4) |
|
82 |
93 |
|
Kohlenwasserstoffe (CxHy) |
|
3 |
5 |
Tabelle 13 Elementaranalyse der wichtigsten flüssigen und gasförmigen Brennstoffe
|
|
Heizöl |
Erdgas L |
Erdgas H |
|
Brennwert kWh/kg (Heizöl) |
12,6
|
9,8 |
11,5 |
|
Heizwert kWh/kg (Heizöl) |
11,9
|
8,8 |
10,4 |
|
Kondenswassermenge maximal |
1,1 |
1,4 |
1,7 |
|
Brennwert/Heizwert |
1,063 |
1,107 |
1,107 |
|
Wasserdampftaupunkt °C λ = 1,3 |
46 |
56 |
56 |
|
Wasserdampftaupunkt °C λ = 1,0 |
51 |
61 |
61 |
|
Luftbedarf λ = 1,0 m³ /kg (Heizöl) |
11,2 |
8,6 |
9,6 |
Tabelle 14 Kennzahlen der wichtigsten flüssigen und gasförmigen Brennstoffe
Aufgabe 20: Warum hat das aus russischem Rohöl gewonnene Heizöl einen überdurchschnittlich hohen Heizwert?
Aufgabe 21: Warum erhöht sich beim Ottomotor die Klopffestigkeit mit der Erhöhung der Oktanzahl?
Aufgabe 22: Warum erhöht sich die Neigung zur Russbildung mit Zunahme des Olefingehalts des Heizöls?
Aufgabe 23: Warum muss bei der Alkoholverbrennung hoher Luftüberschuss gemieden werden?
Aufgabe 24: Was ist der Nachteil von russunterdrückenden Additiven?
Aufgabe 25: Warum bevorzugt man Ethin (Azetylen) beim Schweißen?
Aufgabe 26: Warum ist die Neigung zur Russbildung einer Brennstoffkomponente verbunden mit einem Anstieg der NO-Konzentration im Abgas?
Lösung der Aufgaben
Aufgabe 1: Berechnen Sie anhand Gl. (1) den Kohlenstoffgehalt der gesamten Biomasse der Erde unter der Annahme, dass sowohl die organische Kohlenstoffmasse als auch die Sauerstoffmasse in der Atmosphäre durch die Photosynthese entstanden ist. Die Sauerstoffmasse der Atmosphäre beträgt ca. 1,2 ×109 Millionen Tonne. Vergleichen sie die errechnete Kohlenstoffmasse mit der Masse der Biosphäre in Abbildung 4 der Vorlesung „Feuerungen und Umwelt“.
6 CO2 + 6 H2O + Lichtenergie Þ C6H12O6 + 6 O2
C6H12O6 + 6 O2 Þ 6 C + 6 O2
6∙12 kg + 6∙ 32 kg
12 / 32 = X / (1,2∙109 Mio.t) Þ X = 4,5 ∙ 108 Mio. t = 4,5∙1014 t C
Manuskript Feuerungen u. Umwelt, Abbildung 4: Biomasse 2000 Gt C = 2∙1012 t C; d.h. die gesamte Biomasse der Erde ist ca. Kohlenstoffmasse der Biosphäre.
Aufgabe 2: Zeigen Sie anhand der Reaktionen nach den Gleichungen (1) und (2), dass die Verbrennung fossiler Brennstoffe die Umwandlung von der Sonnenenergie in Wärme bedeutet.
6 CO2 + 6 H2O + Lichtenergie = C6H12O6 + 6 O2
+ C6H12O6 + 6 O2 = 6 CO2 + 6 H2O + Verbrennungswärme
6CO2+6H2O+C6H12O6 +6O2+Lichtenergie = C6H12O6+6O2+6CO2+6H2O+Verbrennungswärme Lichtenergie = Verbrennungswärme
Aufgabe 3: Welcher Anteil der gesamten Biomasse der Erde ist in Form von bekannten Welt-Steinkohlenreserven vorhanden? Entnehmen Sie die zu dieser Aufgabe benötigten Daten aus der Lösung der Aufgabe 1 und aus den Tabellen 2 und 3.
Kohlenstoffmasse: 4,5*1014 t C
Steinkohle: 4,5*1014 (tC) / 0,85 (tC/t Steinkohle) = 5,3 * 1014 t Steinkohle
Tab. 2, 1955: 3,59*1012 / (5,3*1014) = 0,0068 = 0,68 %
Tab. 3, 1986: 3,59*1012 *(1,815/1,041)/ (5,3*1014) = 0,0118 = 1,18 %
Aufgabe 4: Warum neigt die Kohlenverbrennung zu Russbildung?
Bei der Steinkohle liegen nur 10% des Kohlenstoffs frei vor; der Rest ist in einem Verbindungsgemisch enthalten, das vor allem aus aliphatischen und aromatischen Kohlenwasserstoffen besteht. Bei der Verbrennung aromatischer Kohlenwasserstoffe entsteht Russ.
Aufgabe 5: Warum neigt die Holzverbrennung zu Formaldehydbildung?
Organisch gebundener Brennstoffsauerstoff neigt zu Formaldehydbildung bei der Verbrennung. Brennholz enthält sehr viel chemisch gebundenen Sauerstoff (Tab. 1)
Aufgabe 6: 1 Liter Öl kann 1 Million Liter Wasser verseuchen. Wie ist es erklärbar, wenn das Öl in Wasser unlöslich ist?
Öl und Wasser bildet ein Zweiphasengemisch (Suspension) mit einer sehr großen Phasen-Grenzfläche. Die zwei Stoffe des Zweiphasensystems sind sehr schwer voneinander zu trennen.
Aufgabe 7: Was ist die Folge, dass die Ölschicht an der Wasseroberfläche luftundurchlässig ist?
Wenn die Wasseroberfläche mit einem Ölteppich bedeckt wird, kann kein Sauerstoff ins Wasser diffundieren; Lebwesen ersticken unter dem Ölteppich.
Aufgabe 8: Was ist der wesentliche Unterschied zwischen Dieselöl und Heizöl?
Dieselöl und Heizöl sind sich chemisch und physikalisch sehr ähnlich, sie haben die gleiche Dichte, den gleichen Siedebereich u.A. Schwefelgehalt im Dieselöl ist oft niedriger als im Heizöl. Viskosität und Stockpunkt des Dieselöls sind niedriger.
Aufgabe 9: Warum sind die Welt-Rohölreserven während des Zweiten Weltkrieges gesunken und während des Arabisch-Israelischen-Krieges 1973 gestiegen?
1) Während des Zweiten Weltkrieges wurden viel Öl und Ölprodukte verbraucht aber nur wenig Lagerstätten entdeckt worden. 2) Während des Arabisch-Israelischen-Krieges 1973 stiegen drastisch die Ölpreise, d.h. viele Ressourcen wurden zu Reserven erklärt.
Aufgabe 10: Zeigen Sie anhand der Abbildungen dieses Kapitels, dass für die Kommende Generation eine Verknappung fossiler Brennstoffreserven zu befürchten ist.
Abbildung 3: Unterversorgung an flüssigen Kohlenwasserstoffen im Jahr 2020
Abbildung 4: Die durchschnittliche Größe der Gasneufunde nimmt ab
Abbildung 5: Die Abhängigkeit vom Mittleren Osten wird größer
Aufgabe 11: Die Gesamtmenge des nachhaltig verfügbaren Rohholzaufkommens wird auf jährlich ca. 58 Mio. m3 (Festmeter) geschätzt. Bisher wurden davon nur rund 70 % eingeschlagen. Rund 38 Millionen Tonnen leichtes Heizöl sind 1996 in Deutschland verbraucht worden. Wie viel Prozent von diesem Heizöl könnte durch Brennholz ersetzt werden, wenn man das ganze verfügbare Holzaufkommen einschlägt und die hälfte davon als Brennholz verbraucht? Gehen Sie aus einem Mix von 1/3 Fichte, 1/3 Laubholz und 1/3 Schlagbaum bei je 50 % Feuchte aus. Gehen Sie bei den Umrechnungen aus
Festmeter – Schüttraummeter bei Stückholz; Heizwert von Heizöl 1Liter = 10 kWh und
Heizöldichte von 830 kg/m3 aus.
0.5*58 Mio. fm=2,9*107 fm = 5,8*107 Sm (Tab. 9)
((550+650)/2+(900+1000)/2+(450+600)/2)/3 = 692 kWh/Sm (Tab. 10)
5,8*107 Sm * 692 kWh/Sm = 4,012*1010 kWh = 4,012*109 l Heizöl =
4,012*109 l Heizöl = 3,33*109 kg Heizöl = 3,33 Millionen Tonne Heizöl
3,33 / 38 = 0,0876 = 8,76 %
Aufgabe 12: Stellen sie die Reihefolge auf, welche Heizung den Treibhauseffekt mehr verstärkt bei einem Stromverbrauch mit Heizstrom-Mix gemäß Tabelle 11.
A) Wärmepumpe mit Umgebungsluft als Wärmequelle, Jahresleistungszahl 2,5;
B) Wärmepumpe mit Grundwasser als Wärmequelle, Jahresleistungszahl 5,0;
C) Ölzentralheizung, Jahresnutzung 0,7, Stromverbrauch 3 % der Heizwärme;
D) Ölbrennwertnutzung, Jahresnutzung 0,95, Stromverbrauch 7 % der Heizwärme;
E) Gasheizung (Erdgas H), Jahresnutzung 0,7, Stromverbrauch 2 % der Heizwärme;
F) Gasbrennwertnutzung, Jahresnutzung 0,95, Stromverbrauch 7 % d. Heizwärme;
G) Holzpelletsheizung, Jahresnutzung 0,7, Stromverbrauch 5 % der Heizwärme;
H) Brennholzheizung, Jahresnutzung 0,6, kein Stromverbrauch.
Aus Tabelle 11 930 g CO2 /kWh
A 930 / 2,5 = 372 g CO2 /kWh Wärmeenergie
B 930 / 5 = 186
C (311 / 0,7) + 0,03*930 = 472
D (311 / 0,95) + 0,07*930 = 392
E (247 / 0,7) + 0,02*930 = 371
F (247 / 0,95) + 0,07*930 = 325
G (43 / 0,7) + 0,05*930 = 108
E 6 / 0,6 = 10
● Die höchste CO2-Belastung wird von der Ölheizung verursacht.
● Ölbrennwertnutzung ist etwa gleichwertig mit einer normalen Gasheizung und einer
schlechten Wärmepumpe (ca. 25 % günstiger als Ölheizung).
● Die Gasbrennwertnutzung ist ca. 10 % günstiger als Ölbrennwertnutzung.
● Eine gute Wärmepumpe liegt ca. 50 % günstiger als die Gasbrennwertnutzung.
● Bei Holzpelletsheizung liegt die CO2-Belastung 50 % günstiger als bei einer guten
Wärmepumpe.
● Die einfache Holzheizung ist bezogen auf die CO2-Belastung ca. 90 % günstiger als die
Holzpelletsheizung.
Aufgabe 13: Folgende Tabelle zeigt die Kohlendioxid-Emission für Brennholz- und Heizölfeuerung. Berechnen Sie die fehlenden Angaben in der Tabelle unter der Voraussetzung, dass der Wärmebedarf wahlweise mit Holz und/oder mit Heizöl abgedeckt wird. Der Bezugswert für den Wärmebedarf ist die Energie, die bei der Verbrennung von 1000 kg Holz verwertet werden kann. Der Kohlenstoffgehalt des Heizöls ist 86 %. Die CO2-Emission der Brennstoffaufbereitung beider Brennstoffe beträgt 1 kg CO2 je kWh Energiebedarf. Die anzuwendenden Atom- und Molekulargewichte sind: C = 12, O2 = 32.
|
|
Material |
Holz |
Heizöl |
|
1 |
vergleichbare Brennstoffmenge |
1000 kg |
a kg |
|
2 |
Heizwert |
11,9 MJ / kg |
42,7 MJ / kg |
|
3 |
Wirkungsgrad: η |
70 % |
85 % |
|
4 |
Energiebedarf der Aufbereitung |
0,34 MJ / kg Holz |
10,9 MJ / kg Heizöl |
|
5 |
CO2-Emission je kg Brennstoff ohne Aufbereitung |
0 kg CO2 aus Holz (regenerative Energie!!) |
b kg CO2 aus Heizöl |
|
6 |
CO2-Emission der Aufbereitung |
c kg CO2 / kg Holz |
d kg CO2 / kg Heizöl |
|
7 |
CO2-Emission je kg Brennstoff incl. Aufbereitung |
e kg CO2 / kg Holz |
f kg CO2 / kg Heizöl |
|
8 |
CO2-Emission je MJ Nutzenergie incl. Aufbereitung |
g kg CO2 / MJ Nutzenergie |
h kg CO2 / MJ Nutzenergie |
|
9 |
CO2-Emission äquivalent zu 1000 kg Brennholz, incl. Aufbereitung |
j kg CO2 |
k kg CO2 |
CO2-Emission der Brennstoffaufbereitung
1 kg CO2 / kWh → 1 kg CO2 / 3600 kJ → 0,278 kg CO2 / MJ
0,86 kg C / kg Heizöl → 0,86∙(12+32) /12 = 3,15 kg CO2 / kg Heizöl
a Holzheizung
(1000 kg Holz) (11,9 MJ/kg Holz) = 11900 MJ wird frei.
Wirkungsgrad 70 % → in der Wohnung bleibt 0,7 ∙ 11900 MJ = 8330 MJ
Ölheizung
In der Wohnung bleibt 8330 MJ
Wirkungsgrad 85 % → durch Ölverbrennung freiwerdende Energie
8330 MJ / 0,85 = 9800 MJ
(9800 MJ) / (42,7 MJ / kg Heizöl) = 229,5 kg Heizöl
b 0,86∙(12+32) /12 kg CO2 / kg Heizöl b = 3,15
kWh – MJ – Umrechung
c 0,278∙0,34 = 0,0944 kg CO2 / kg Holz c = 0,0944
0,278 (kg CO2 / MJ)∙0,34 (MJ/kg Holz)
Zeile 4
d 0,278∙10,9 = 3,03 kg CO2 / kg Heizöl d = 3,03
Zeile 4
e 0,0944 kg CO2 / kg Holz e = 0,0944
e = c
f 3,03 + 3,15 = 6,18 kg CO2 / kg Heizöl f = 6,18
g 0,0944 / (0,7*11,9) = 0,01133 kg CO2 / MJ Nutzenergie g = 0,01133
e/(Heizwert*Wirkungsgrad)
h 6,18 / (0,85*42,7) = 0,1703 kg CO2 / MJ Nutzenergie h = 0,1703
f / (Heizwert*Wirkungsgrac)
j 0,0944∙1000 = 94,4 kg CO2 j = 94,4
e * Brennstoffmenge
k 6,18 ∙229,5 = 1418,6 kg CO2 k = 1418,6
f* Brennstoffmenge
Aufgabe 14: Berechnen Sie aus folgender Abbildung den Brennstoffanteil für Heizung und Warmwasserbereitung unter der Annahme, dass der 1-%-Anteil für (Kohle/Holz) sich a) lediglich auf Kohlenfeuerungen (Steinkohle nach Tabelle 11), und b) lediglich auf Holzfeuerungen (Brennholz nach Tabelle 11) bezieht.


Quelle: Stadt Gütersloh, FB Umweltschutz; Bearbeitet durch ©UMBLICK, September 2000
|
|
Strom |
Gas |
Heizöl |
Kohle |
|
Anteil an CO2-Belastung [%] |
20 |
12 |
67 |
1 |
|
g CO2 / kWh (Tab. 11) |
930 |
247 |
311 |
439 |
|
Anteil [ kWh / g CO2] |
0,2 / 930 = 2,15E-4 |
0,12/247= 4,86E-4 |
0,67/311= 2,03E-3 |
0,01/439= 2,28E-5 |
|
Gesamt [kWh / g CO2] |
2,75E-3 |
|||
|
Anteil an kWh [%] |
7,82 |
17,7 |
73,1 |
0,83 |
|
|
Strom |
Gas |
Heizöl |
Brennholz |
|
g CO2 / kWh (Tab. 11) |
930 |
247 |
311 |
25 (Mittelwert) |
|
Anteil an CO2-Belastung [%] |
20 |
12 |
67 |
1 |
|
Anteil [ kWh / g CO2] |
0,2 / 930 = 2,15E-4 |
0,12/247= 4,86E-4 |
0,67/311= 2,03E-3 |
0,01/25 4E-4 |
|
Gesamt [kWh / g CO2] |
3,13E-3 |
|||
|
Anteil an kWh [%] |
6,87 |
15,5 |
64,7 |
12,8 |
Aufgabe 15 Die Rohstoffreserven sind eine variable Größe. Weshalb?
Die Einstufung Ressource – Reserve hängt von vielen Faktoren ab, die sich täglich ändern Können (z.B. Energiepreis).
Aufgabe 16 Die Primärenergieversorgung der Welt wird heute zu etwa 80% von
3 Energieträgern getragen. Diese sind
1. ....................Kohle................. 2. ............Öl....................... 3. ...............Gas........................
Aufgabe 17 Erdgas bildet sich oft zusammen mit Erdöl, es kann aber auch durch die Entgasung von ......Kohlelagerstätten ….. entstehen.
Aufgabe 18 Voraussetzungen die erfüllt sein müssen, damit Kohlenlagerstätten entstehen können.
1. ..............Sauerstoffabschluss.................................................................................................
2. ..............Hoher Druck......................................................................................................
3. ..............Hohe Temperatur.....................................................................................................
Aufgabe 19 Steinkohlen sind in der Regel jünger (nein!), härter (ja!),
energiereicher (ja!), wasserhaltiger (nein!) als Braunkohlen. (Streichen Sie die falschen Angaben!)
Aufgabe 20: Warum haben hat das aus russischem Rohöl gewonnene Heizöl einen überdurchschnittlich hohen Heizwert?
Das russische Rohöl besitzt einen überdurchschnittlich hohen Gehalt an Naphtenen, die wegen der höheren Bindungsspannung in der Molekularstruktur einen höheren Heizwert aufweisen als die paraffinhaltigen Öle.
Aufgabe 21: Warum erhöht sich beim Ottomotor die Klopffestigkeit mit der Erhöhung der Oktanzahl?
Die Oktanzahl bedeutet einen hohen Gehalt an Isooktan bzw. damit vergleichbaren Kraftstoffkomponente. Isooktan wiederum hat wegen der kompakten Molekularstruktur eine überdurchschnittlich hohe Zündtemperatur und somit eine verminderte Neigung zur Selbstzündung.
Aufgabe 22: Warum erhöht sich die Neigung zur Russbildung mit Zunahme des Olefingehalts des Heizöls?
Olefine weisen Doppel- und Dreifachbindungen auf. Diese Bindungen neigen bei der Pyrolyse zur Polymerisation und sind damit „Russbausteine“.
Aufgabe 23: Warum muss bei der Alkoholverbrennung hoher Luftüberschuss gemieden werden?
Alkohole zeigen wegen des chemisch gebundenen Sauerstoffatoms erhöhte Neigung zur Formaldehydbildung. Die Formaldehydbildung verstärkt sich bei der Verbrennung mit hohem Luftüberschuss.
Aufgabe 24: Was ist der Nachteil von russunterdrückenden Additiven?
Russunterdrückende Additive haben eine oxidierende katalytische Wirkung. Damit erhöht sich der Schwefeltrioxidanteil im Abgas, d.h. das Abgas wirkt sehr korrosiv.
Aufgabe 25: Warum bevorzugt man Ethin (Azetylen) beim Schweißen?
Die Azetylenflamme ist sehr russhaltig. Die erhöhte Russkonzentration der Flamme lässt bei der Schmelze Kohlenstoff in den Stahl diffundieren. Der erhöhte Kohlenstoffgehalt reduziert die Sprödigkeit der Schweißnaht.
Aufgabe 26: Warum ist die Neigung zur Russbildung einer Brennstoffkomponente verbunden mit einem Anstieg der NO-Konzentration im Abgas?
Brennstoffe mit erhöhter Neigung zur Russbildung können nicht im Luftmangelbereich verbrannt werden. Die gestufte Verbrennung, eine Maßnahme zu Reduzierung von NO-Bildung, ist wegen der erhöhten Neigung zur Russbildung nicht optimal anwendbar.